
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическое равновесие между идеальными газами.
Предположим, что в идеальной газовой смеси идёт реакция

|
Пусть в равновесии установились парциальные давления газов равные Ра, РВ, Рс, Рd. Химический потенциал каждого компонента можно записать в виде

|
(7.2)
Надо помнить, что формула (7.2) на самом деле выглядит так

т.е. в (7.2) давление под логарифмом всегда имеет размерность [атм].
Подставим в условие равновесия (7.1) значения химических потенциалов компонентов. Получаем

Перенесём все члены, содержащие давление в левую, а стандартный химический потенциал - в правую часть уравнения:

Для идеальных газов величины  являются функциями только температуры и не зависят от давления и состава. Следовательно
являются функциями только температуры и не зависят от давления и состава. Следовательно

где 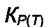 - константа равновесия, зависящая только от температуры. Индекс "Р" означает, что константа равновесия выражена в единицах давления (атм.). При Т = const независимо от начальных парциальных давлений компонентов конечные равновесные парциальные давления участников реакции установятся такими, чтобы удовлетворить условию (7.3), где
- константа равновесия, зависящая только от температуры. Индекс "Р" означает, что константа равновесия выражена в единицах давления (атм.). При Т = const независимо от начальных парциальных давлений компонентов конечные равновесные парциальные давления участников реакции установятся такими, чтобы удовлетворить условию (7.3), где  = const.
= const.
Дата добавления: 2014-12-23; просмотров: 298; Мы поможем в написании вашей работы!; Нарушение авторских прав |