
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Разность стандартных химических потенциалов продуктов и исходных веществ представляет собой стандартный изобарно -изотермический потенциал реакции, т.е.
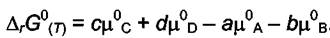
С учётом этого можно записать
 (7.4)
(7.4)
Величина  - это изменение потенциала Гиббса при превращении "а" молей газа "А" взятого при парциальном давлении 1атм и "b" молей газа "В" взятого при парциальном давлении 1атм в "с" молей газа "С" и "d" молей газа "D", взятых также при парциальных давлениях равных 1 атм. Таким образом величина
- это изменение потенциала Гиббса при превращении "а" молей газа "А" взятого при парциальном давлении 1атм и "b" молей газа "В" взятого при парциальном давлении 1атм в "с" молей газа "С" и "d" молей газа "D", взятых также при парциальных давлениях равных 1 атм. Таким образом величина  , характеризующая состояние равновесия, оказывается связанной с величиной
, характеризующая состояние равновесия, оказывается связанной с величиной  , характеризующей работу химической реакции в стандартных условиях, которые отличаются от равновесных. Величины
, характеризующей работу химической реакции в стандартных условиях, которые отличаются от равновесных. Величины  и
и  имеют смысл только для данной записи химической реакции с определёнными стехиометрическими коэффициентами. Желательно, чтобы хотя бы один стехиометрический коэффициент (для реагентов или продуктов) был равен единице. Тогда величина
имеют смысл только для данной записи химической реакции с определёнными стехиометрическими коэффициентами. Желательно, чтобы хотя бы один стехиометрический коэффициент (для реагентов или продуктов) был равен единице. Тогда величина  , имеющая размерность кДж/моль может быть отнесена к превращению моля этого вещества в результате данной химической реакции.
, имеющая размерность кДж/моль может быть отнесена к превращению моля этого вещества в результате данной химической реакции.
Строго говоря, в формуле (7.3) величина  - безразмерная величина, так как в выражении для химического потенциала под логарифмом стоит давление газа делённое на стандартное давление 1атм. Величина КР может быть и размерной величиной, но давления газов должны выражаться в "атм". Этим обозначается выбор стандартного состояния, которое соответствует давлению 1атм.
- безразмерная величина, так как в выражении для химического потенциала под логарифмом стоит давление газа делённое на стандартное давление 1атм. Величина КР может быть и размерной величиной, но давления газов должны выражаться в "атм". Этим обозначается выбор стандартного состояния, которое соответствует давлению 1атм.
Дата добавления: 2014-12-23; просмотров: 232; Мы поможем в написании вашей работы!; Нарушение авторских прав |