
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
С помощью универсальных иономеров
Универсальные иономеры в комплекте с соответствующими ионоселективными электродами предназначены для определения активности одно - и двухвалентных анионов и катионов (величины рХ), а также для измерения окислительно-восстановительных потенциалов (величины Е) в этих же растворах. Иономер может использоваться также в качестве высокоомного милливольтметра. В настоящее время известные фирмы различных стран выпускают самые различные марки иономеров. В Казахстане широко распространены иономеры марок рН-340, ЭВ-74, И-102, И-120, И-130 и другие, изготавливаемые в России и других странах СНГ. В универсальных иономерах для измерения величины рН используется система со стеклянным электродом с водородной функцией (дальше речь идет только о стеклянных электродах с водородной функцией) и вспомогательным (хлорсеребряным) электродам, схема которой приведена на рис. 39. Стеклянный электрод состоит из трубки, конец которой сделан в виде полого шарика (1) из очень тонкого стекла, проницаемого для конов водорода. Шарик содержит кислый раствор с известным значением рН, в который погружен хлорсеребряный электрод (серебряная проволока, полностью покрытая хлоридом серебра).
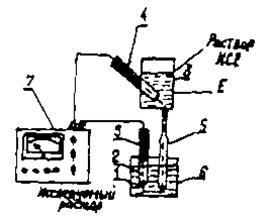
| Хлорсеребряный электрод выполняет роль внутреннего контактного электрода (3) и осуществляет электрический контакт с раствором, заполняющим внутреннюю часть стеклянного электрода (2). При погружении электрода в раствор между поверхностью шарика (1) стеклянного электрода и раствором происходит обмен ионами, в результате которого ионы лития или натрия в поверхностных слоях стекла замещаются ионами водорода, и |
| Рис.39. Универсальный иономер |
стеклянный электрод приобретает свойства водородногоэлектрода.
Между поверхностью стекла и исследуемым раствором возникает разность потенциалов ЕХ, величина которой определяется концентрацией ионов водорода в растворе и его температурой.
Но измерение потенциала Ех, возникающего на наружной поверхности стеклянного электрода, невозможно по причинам, возникающим при попытке измерения потенциала любого единичного электрода. Поэтому стеклянный электрод сочетают с каким-либо другим электродом, дающим определенный и хорошо воспроизводимый скачок потенциала. Такие электроды называются вспомогательными электродами (4) или электродами сравнения. В универсальных иономерах в качестве вспомогательного электрода применяются, как правило, проточный злектрод состоящий из хлорсеребряного электрода (4), бачка (8) и электролитического ключа (5) с пористой перегородкой. Связь вспомогательного хлорсеребряного электрода (4) с исследуемым раствором осуществляется с помощью бачка (наполненной насыщенным раствором хлорида калия) и электролитического ключа (5) - трубки, наполненной насыщенным раствором хлорида калия и заканчивающейся пробкой со стеклянным волокном (6). Раствор хлорида калия непрерывно просачивается через стеклянное волокно пробки, предотвращая проникновение из исследуемого раствора в систему электрода (4) посторонних ионов, которые могли бы изменить величину потенциалов электрода.
Между поверхностью стекла и исследуемым раствором возникает разность потенциалов, величина которой определяется концентрацией ионов водорода в растворе и его температурой.
Подготовка иономера к работе.
Прежде чем приступить к работе необходимо по инструкции, прилагаемому к прибору, ознакомиться с расположением отдельных узлов и органов управления, а также с правилами включения прибора и измерения рН раствора.
Перед началом работы следует прибор включить в сеть и прогреть в течение 30 минут. При измерении рН растворов следует выбрать электрод с водородной функцией. Перед работой следует произвести подготовку электродов в соответствии с указаниями, изложенными в паспортах на электроды. Электроды с водородной функцией следует вымочить в 0,1М растворе соляной кислоты не менее одной сутки. При более срочных ситуациях следует вымачивать в более концентрированных растворах соляной кислоты.
Перед измерениями произвести калибровку иономера с помощью контрольных растворов. При измерении рН в качестве контрольных растворов используют стандартные буферные растворы, приготовляемые из стандарт -титров по ГОСТ 8.135-74, которые действует до сих пор и на территории Казахстана. Значение рН буферных растворов приведены в таблице.
| T, 0С | Раствор №1 | Раствор №2 | Раствор №3 | Раствор №4 | Раствор №5 |
| 1,675 | - | 4,002 | 6,881 | 9,225 | |
| 1,688 | 3,557 | 4,008 | 6,865 | 9,180 |
Раствор №1 - 0,05М раствор тетраоксалата калия.
Раствор №2 - насыщенный при 200С раствор гидротартрата калия.
Раствор №3 - 0,05М раствор гидрофталата кислого.
Раствор №4 Смесь 0,025М раствора гидрофосфата калия и 0,25М раствора дигидрофосфата натрия.
Раствор №5 - 0,01М раствор тетрабората натрия (буры).
Перед погружением в раствор электроды следует промыть дистиллированной водой и удалить остатки воды фильтровальной бумагой. При точных измерениях рекомендуется электроды промыть анализируемым раствором.
Обычно время установления показаний не превышает 3 минуты. Однако при измерениях рН растворов слабой концентрации, а также при измерениях рН сильнокислых и сильнощелочных растворов при температурах, близких к 00С время установления показаний может возрасти до 10 минут.
Настройку производят по двум контрольным растворам, значения рН которых должны лежать в диапазоне измерений применяемой электродной системы.
Проверка показаний прибора и определение рН растворов
1. Проверить показания прибора по стандартному буферному раствору, приготовленному из тетраоксалата калия. Значение рН 0,05 М раствора тетраоксалата калия при температуре 20°С равно 1,68. Электроды погрузить в 0,05 М раствор тетраоксалата калия и измерить его рН, руководствуясь правилами инструкции, описанными в параграфе «Включение прибора и порядок измерения рН растворов Стрелка показывающего прибора должна установиться на отметке 1,68 единиц рН, в противном случае необходимо обратиться к преподавателю. Проверить показания прибора по 0,01 М раствору тетрабората натрия, рН которого при температуре 20 С равен 9,22.
2. Определить рН свежеприготовленных 0,1 н растворов соляной кислоты и гидроксида натрия. Сопоставить найденные значения рН с рассчитанными значениями рН указанных растворов.
3. Определить рН 0,1 н раствора уксусной кислоты и сопоставить его с рН 0,1 н раствора соляной кислоты. Объяснить причину различия в значениях рН растворов уксусной и соляной кислот. По величине рН в 0.1н растворе вычислить константу К и DG0 диссоциации уксусной кислоты.
4. В стакан с 0,1 н раствором уксусной кислоты добавить равный объем 0,1 нраствора ацетата натрия. Тщательно перемешать растворы и определить рН. Найденное значение рН сопоставить с рН 0,1 нраствора уксусной кислоты. Объясните изменение рН раствора уксусной кислоты при добавлении раствора ацетата натрия.
Дата добавления: 2014-12-30; просмотров: 340; Мы поможем в написании вашей работы!; Нарушение авторских прав |