
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химиялық байланыстың табиғатының валенттік байланыстар әдісін баяндаңыз.
Атомдар молекула түзгенде энергия ұтымы болады, демек, молекула атомдарға қарағанда тұрақты жүйе. Мысалы, сутек атомдары молекулаға біріккенде 431,9 кДж/моль энергия бөлініп шығады.
Н + Н = Н2 Н = 431,9 кДж/моль
Энергия ұтымы не себептен және қандай жағдайларда болады? Бұл мәселені сутек атомдарының сутек молекуласын түзуі мысалында қарастырамыз.
Сутек атомының жалғыз s-электроны бар , 1s1 s – элекрон бұлтының пішіні шар тәрізді. Сутектің екі атомы біріне – бірі жақындасқанда олардың арасында екі түрлі электростатикалық күштер туады: тартылу және тебілу күштері
Сутек атомдарының әсерлесуі.Бір атомның электрон бұлты екінші атомның ядросына тартылады. Біздің мысалымызда На атомының электрон бұлты Нб атомының ядросына және керісінше, Нб атомының электрон бұлты На атомның ядросына тартылады. На және Нб атомдарының ядролары өзара тебіседі, дәл осы сияқты олардың электрон бұлттары да бір – бірін тебеді.
Валенттік байланыс (ВБ) әдісі бойынша сутек атомдары жақындасқанда тартылысу және тебісу күштерінің қалай өзгертетінін есептеп, жүйенің потенциалдық энергия қисығын салуға болады. Бірінші рет мұндай есептеуді 1927 – жылы неміс ғалымдары Гейтлер мен Лондон орындаған. Осындай есептеудің нәтижесінде мынандай жағдай анықталды. Электрондарының спиндері қарама – қарсы сутек атомдары жақындасқанда, жүйенің потенциалдық энергия қисығында минимум пайда болады. Бұл жағдай сутек атомдарының өзара қосылысып, молекула түзгенін көрсетеді. Электрондарының спиндері параллель сутек атомдары жақындасқанда, жүйенің потенциалдық энергиясы атомдар жақындасқан сайын үздіксіз өседі. Бұл жағдай спиндері параллель сутек атомдарының молекула құрап бірікпейтінін көрсетеді.
Сонымен қатар осы екі жағдайға сәйкес ядролар арасындағы кеңістіктіктегі электрон бұлтының тығыздықтары да есептелінген. Спиндері антипараллель атомдар жақындасқанда ядролар арасындағы кеңістікте электрон бұлтының тығыздығы артады, яғни аомдардың электрон бұлттары өзара бүркеседі. Электрон бұлттарының өзара бүркесуінен ядролар арасындағы кеңістікте тығыз электрон зонасы пайда болады. Оң зарядталған ядролар осы теріс зарядты зонаға тартылып, тұрақты жүйе сутек молекуласы түзіледі.
Электрондардың спиндері параллель атомдар жақындасқанда ядролар арасындағы кеңістіктегі электрон бұлтының тығыздығы нөлге жуық, яғни бұл жағдайда әсерлесуші атомдардың электрон бұлттары өзара бүркеспей керісінше тебіседі. Сол себептен спиндері параллель атомдар жақындасқанда химиялық байланыс түзілмейді.
3. Молекулалық орбитальдар әдісі тұрғысынан байланыстар әдісін түсіндіріңіз.Негізгі қағидалары:
1. Молекула - біртұтас жүйе, ондағы барлық электрондар сол молекулаға ортақ.
2. Молекуладағы электрон атомдағыдай бір ядроның өрісінде емес молекула құрамындағы барлық ядролар өрісінде болады.
3. Молекуладағы әр электронға молекулалық орбиталь сәйкес келеді.
4. Молекулалық орбитальдарға электрондардың орналасуы орбитальдардың энергиясы өсуіне қарай Паули принципі және Хунд ережесіне сәйкес жүзеге асырылады.Байланыстыратын және босаң орбитальдар.
Молекулалық орбитальдар атом орбитальдарының қосылуы немесе алынуы арқылы түзіледі. (1 ( ( 1/2 (1Sа + 1Sб)
(2 ( ( 1/2 (1Sа - 1Sб)
Атом орбитальдары қосылғанда, жаңадан түзілген молекулалық орбитальдың энергиясы төмен болады - бұл байланыстыратын орбиталь.
Атом орбитальдарының функциялары бір-бірінен алынғанда түзілген молекулалық орбитальдың энергиясы жоғары болады - бұл босаң орбиталь (S-S пен (-бос).
Байланыс саны (Б.С.)
Б.С. = 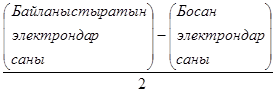
Б,С неғұрлым жоғары болса, соғұрлым байланыс берік болады.
1. Н2 молекуласын қарастырайық. Бұл молекулада екі электрон бар. Н2 молекуласының электрондық формуласы ((-байл.)2 деп жазылады. Б.С. = 2- 0 / 2 = 1
 3.3-сурет
3.3-сурет
|
2. Не2 молекуласы Б.С. = 2- 2/ 2 = 0 Б.С. - 0-ге тең - молекула түзілмейді.
ІІ период.
ІІ периодтың элементтері байланыс түзгенде, 1s- орбитальдардан басқа 2s, 2рх , 2ру, 2рz- орбитальдары қатысады. Сонда ((1S)байл., ((1S)бос. молекулалық орбитальдардан басқа орбитальдар да қатысады:
((2S)байл.<((2S)бос<(2Pz)<((2Px)байл=((2Py)байл< ((2Px)бoc=((2Py)бoc<((2Pz) бос.
немесе
(2Sбайл., (2Sбос, (z, (xбайл, (yбайл , (xбoc, (yбoc, (z бос. (қысқаша түрі)
Ковалентті байланыстың қасиеттері
1. Коваленттік байланыс қаныққан байланыс, оның себебі электрон жұбы түзілгенде, ол жерде үшінші электрон болмайды.
2. Ковалентті байланыстың полярленуі: әр түрлі химиялық қосылыстар атомның бір түрінен тұрмайды, егер химиялық коваленттік байланысты екі түрлі атом түзсе, электрон қосағының бұлты пішінін өзгертіп, электр терістігі үлкендеу атомға қарай ығысады. Осы құбылысты полярлену құбылысы дейді.
3. Ковалентті байланыстың бағытталуы.
Ковалентті байланыстың екі атомның электрон бұлттары бүркескенде түзілетінін білеміз. Егер орбитальдардың бүркесу бөлігі байланысушы атомдардың ядроларын жалғастыратын түзу сызықтың бойына орналасса, s-байланыс түзіледі. s _ s, р _ р, s _ d, р _ d _ d. s - байланыс берік байланыс.
 s s s _ р р _ р
s s s _ р р _ р
|

|
р _ р р _ d d _ d
Ал егер орбиталдердің бүркесу бөлігі ядроларды жалғастыратын түзудің бойында емес, сол түзудің екі жағына орналасса p-байланыс орын алады.
Кейбір молекулаларда әрі s - байланыс әрі p -байланыс түзіледі. Бұл - еселі байланыстар.
Дата добавления: 2015-01-01; просмотров: 574; Мы поможем в написании вашей работы!; Нарушение авторских прав |