
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Комплексті қосылыстыр химиясының заманауи негізгі түсініктерін айтыңыз.
А. Вернер қатты күйінде де, суда ерігенде де тұрақты болып келетін күрделі жоғары ретті қосылыстарды координациялық немесе кешенді қосылыстар деп атады. Координация термині бір бөлшектің жанында басқа бірнеше бөлшектер шоғырлануын білдіреді.
CuSO4+5H2O=[Cu(H2O)4]SO4×H2O
Координациялық қосылыстар кешенді бөлігіндегі орталықта кешентүзуші мыс ионын Cu2+ лигандтар – төрт су молекуласы қоршап тұр. Кешентүзуші мен лигандтар бірігіп координациялық қосылыстары ішкі сферасын, ал қалғандары (SO  , H2O) сыртқы сфераны құрайды. Ішкі сфераны басқа бөлігінен айыру үшін шаршы (квадрат) жақшаға алып жазады:
, H2O) сыртқы сфераны құрайды. Ішкі сфераны басқа бөлігінен айыру үшін шаршы (квадрат) жақшаға алып жазады:
[NH4]Cl , [Ag(NH3)2]Cl, K3[Fe(CN)6], [Pt(NH3)2Cl2]Cl2
Бұлардан орталықтағы кешентүзушінің маңына шоғырланған лигандтар: иондар, бейтарап молекулалар болатыны көрініп тұр. Кешентүзушінің айналасындағы шоғырланған лигандтар саны координациялық сан деп аталады. Жиі кездесетін координациялық сан мәндері 4 пен 6, одан кейінгілері 2 мен 8.
Кешенді ионның заряды сыртқы сферадағы иондардың зарядының қосындысына тең, тек мәндері қарама-қарсы болады. Айталық, K3[ 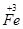 (
( 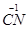 )6] сыртындағы калий иондарының зарядының қосындысы +3, ал кешенді ионның заряды
)6] сыртындағы калий иондарының зарядының қосындысы +3, ал кешенді ионның заряды
[+3+(-6)]=-3 Егер кешентүзушінің заряды белгісіз болса оны қалғандарының зарядтарының қосындысын шығарып, оны теріс мәнді етіп қойса жеткілікті.
Мысалы, 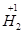 [Si
[Si 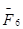 ]координациялық қосылыстағы кешен түзуші Si заряды [2×(+1)+6×(-1)]=+4 ке тең.
]координациялық қосылыстағы кешен түзуші Si заряды [2×(+1)+6×(-1)]=+4 ке тең.
Кешен түзушінің координациялық саны аса маңызды сипаттама болып саналады, өйткені ол кешеннің құрамы мен құрылымын анықтайды. Анығырақ айтқанда, координациялық сан орталықтағы кешентүзушінің айналасында қанша орын бар екенін көрсетеді. Кешеннің құрамына енген лигандтар екі не одан да көп орын алуы мүмкін. Ондай лигандтарды полидентатты (көп тісті) деп атайды. Жоғарыда келтірілген кешенді қосылыстардың құрамындағы лигандтар монодентатты, себебі: олар кешен түзушінің жанындағы бір ғана орынды иеленді. Дентаттылығы бойынша 1 (моно), 2 (ди), 3 (три), 4 (тетра), 5 (пента), 6 (гекса), 7 (гепта), 8 (окта), 9 (ноно), 10 (дека) т.б. бола алады. Дидентатты кешенге этилендиамин H2N-CH2-CH2-NH2 жатады. Полидентатты кешендерді хелаттар деп те атайды.
Кешенді қосылыстардың жіктелуі мен аталуы.Координациялық қосылыстардың кешенді ионының заряды бойынша оларды катионды, анионды және бейтарап деп жіктейді. Орталықтағы оң ионның айналасына бейтарап молекулалар (Н2О, NH3 т.б) шоғырланғанда катионды кешенге жатады:[Al(H2O)6]+3Cl3, [Zn(NH3)4]+2Cl2. Егер кешентүзушіні теріс зарядты аниондар: Cl-, F-, SO  , OH-, CN- т.б қоршаса анионды кешенге жатады: K2[AlF4]-2, Na[Al(OH)4]-1, K2[SO4]-2, Li[Al(OH)4]-1. Егер кешентүзушінің айналасына өз ионымен қоса бейтарап молекулалардан тұратын лигандтар шоғырланса бейтарап кешендер түзіледі: [
, OH-, CN- т.б қоршаса анионды кешенге жатады: K2[AlF4]-2, Na[Al(OH)4]-1, K2[SO4]-2, Li[Al(OH)4]-1. Егер кешентүзушінің айналасына өз ионымен қоса бейтарап молекулалардан тұратын лигандтар шоғырланса бейтарап кешендер түзіледі: [  (
( 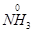 )
)  ]0 Бұл жіктеу бойынша кешенді қосылыстың зарядтан басқа сипаты айқындалмайды.
]0 Бұл жіктеу бойынша кешенді қосылыстың зарядтан басқа сипаты айқындалмайды.
Кешентүзушінің қызметін периодтық кестедегі кез келген элемент атқара алады. Мысалы, анионды кешендердің кешентүзушісі бейметалдарды алайық. K3[PO4]-3, K[PF6]-1. Десек те типтік металдық, сілтілік, сілтілік жер элементтері бейорганикалық лигандтармен кешен түзуге онша бейім келмейді. Кешентүзушімен әлсіз байланысқан олардың қосылыстары көбіне катионды болып келеді: [Ca(NH3)6]Cl2. Нағыз координациялық қосылыстарды түзгіштер d және f элементтердің қосылыстары. Екідайлық қабілеті бар элементтер катионды да, анионды да кешендер түзе береді:[Al(H2O)6]+3Cl3, K[Al(OH)4]-1
Лигандтар бойынша жіктеу кешендердің табиғатын тануға мүмкіндік береді. Алдымен құрамында молекулалық монодентатты лигандтарды қарастырайық, оларға аквокешендер, амминкешендер (қысқаша амминдер), металл карбонильдері жатады. Құрамына лигандтар ретінде су молекуласы ғана енетін болса аквокешендер [Co(H2O)4]×SO4×H2O, аммиактан амминкешендер [Co(NH3)6]Cl2, көміртек (II) оксидінен карбонилдер түзіледі.
Лигандтары қышқыл қалдықтары, басқа да аниондар болып келетін кешендердің жалпы аталуы ацидокешендер. Оларды дәлірек лигандтарының түріне орай фторо [AlF6]3-, бромо [AuBr4]- циaно [Au(CN)6]- йодо [TiI4]- кешендер деп те атайды. Егер құрамына ОН- иондары енсе гидроксокешендер шығады: K2[Be(OH)4], Na2[Zn(OH)4] т.т.
Галогендердің молекулалары бос галогендермен және күкіртпен толықса полигалогенидтер K[I×I2] немесе K[I3] және полисульфидтер K2S×S=K2[S2] шығады.
Халықаралық атаулар жүйесінің талаптарына сай кешенді қосылыстар құрамындағы теріс зарядталған бір элемент атомының лигандтарының атауының түбірінің соңына «о» деген дауысты дыбыс жалғанады. Мысалы, F-(фторо), Cl-(хлоро), O-2 (оксо) дәстүр бойынша күкірттің анионы S-2 (тио) т.б. Күрделі құрамды аниондардың «ат» жұрнағының соңына «о» дыбысын қосады: SO  (сульфато), NO
(сульфато), NO  (нитрато), CO
(нитрато), CO  (карбонато). Ал негіздерге тән гидроксид ионы кешенді қосылыстары лигандына айналғанда қысқартып, гидроксо сөзін қолданады. Егер лигандтар бейтарап бөлшек түрінде болса негізінен олардың көпшілікке таныс халықаралық атаулары аталады: H2O (акво), NH3(аммин), CO(карбонил), CS(тиокарбонил), NO(нитрозил) т.б.
(карбонато). Ал негіздерге тән гидроксид ионы кешенді қосылыстары лигандына айналғанда қысқартып, гидроксо сөзін қолданады. Егер лигандтар бейтарап бөлшек түрінде болса негізінен олардың көпшілікке таныс халықаралық атаулары аталады: H2O (акво), NH3(аммин), CO(карбонил), CS(тиокарбонил), NO(нитрозил) т.б.
Сыртқы сфералы бейтарап кешенді қосылыстардың атауы былайша құрылады: шаршы жақшада орналасқан құраушылардың алдымен сандары көрсетілген теріс зарядты лигандтар, одан соң бейтарап лигандтар, ақырында кешен түзушінің өзі қосылып бүкіл атау бірге аталады. Мысалы, [Pt(NH3)2Cl2] дихлородиамминплатина(0), мұндағы 0 – кешенді қосылыстың бейтараптылығын көрсетеді. [Al(H2O)6]Cl3 гексааквоалюминий(III)хлориді немесе гексааквоалюминийтрихлориді, [Co(NH3)4Cl]SO4 монохлоротетраамминкобальт(III)сульфаты, [Co(NH3)6](SO4)Cl гексаамминкобальт(III)хлорид-сульфаты.
5. Менделеевтің периодтық заңы – атом ядросы зарядтарының артуына байланысты химиялық элементтер қасиеттерінің периодты өзгеретінін тұжырымдайтын табиғаттың негізгі заңы.
Периодтық кестеде вертикаль бағаналардағы элементтердің қасиеті, жоғарыдан төмен қарай металдық қасиеттің күшеюімен өзгереді. Мұнын себебі, әр элементтің әр периодта орналасуында. Яғни, период саны артқан сайын элементтің атом радиусы артып, электрон бергіштік қасиет артады, электртерістік қасиеті төмендейді. Сонымен, периодтық кестеде период санының артуына байланысты элементтің металдық қасиеті артады, керісінше бейметалдық қасиеті кемиді.
Периодтық кестеде горизонталь бағытта орналасқан элементтер, яғни бір периодта орналасқан, бірақ топ саны артатын элементтердің қасиеттері солдан оңға қарай бейметалдық қасиет артады, металдық қасиеті төмендейді.
Марганец элементінің периодтық кестеде қасиеттерінің өзгеруін қарастырайық:
· Марганец элементінің периодтық кестеде горизонталь бағытта, оның бейметалдық қасиеті артады. Яғни, периодтық кестеде элементтердің солдан оңға қарай жылжуынан элементтердің бейметалдық (қышқылдық) қасиеті артады.
· Марганец элементінің периодтық кестеде вертикаль бағытта, оның металдық қасиеті артады. Яғни, периодтық кестеде жоғарыдан төмен қарай бағытта элементтердің металдық (сілтілік) қасиеті күшейеді.
| Окисленная форма | Восстановленная форма | Среда | E0, В |
| Mn2+ | Mn | H+ | −1,186 |
| Mn3+ | Mn2+ | H+ | +1,51 |
| MnO2 | Mn3+ | H+ | +0,95 |
| MnO2 | Mn2+ | H+ | +1,23 |
| MnO2 | Mn(OH)2 | OH− | −0,05 |
| MnO42− | MnO2 | H+ | +2,26 |
| MnO42− | MnO2 | OH− | +0,62 |
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ |
Атом құрылысының қазіргі заманғы теориясына сүйене отырып атомдардың электрондық құрылымы мен периодтық заңды Cr элементімен түсіндіріңіз
ХРОМ «Cr24» – периодтық жүйе бойынша 4 период, 4 қатар, VI топтың қосымша топшасында орналасқан қара металдар қатарына жататын көкшіл түсті қатты металл.
Cr241s22s22р23s2 3р64s14d5


 1)
1)








 2)
2)
 |

 3)
3)
 |
|





 4)
4)
Cr- 1s22s22р23s2 3р64s14d5 , атомдық массасы: 51,9961 г/моль; атом радиусы: 130 пм;
Ковалентті радиусы; 118 пм

Дата добавления: 2015-01-01; просмотров: 487; Мы поможем в написании вашей работы!; Нарушение авторских прав |