
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ПРИЛОЖЕНИЕ 1.
ВОПРОСЫ ДЛЯ КОНТРОЛЯ ИСХОДНОГО УРОВНЯ ЗНАНИЙ
( II уровень )
1. Дайте определение понятию артериальная гипертензия.
2. Укажите формы артериальной гипертензии, дайте определение гипертонической болезни.
3. Факторы риска развития гипертонической болезни?
4. Охарактеризуйте патогенетические механизмы формирования артериальной гипертензии.
5. Диагностика артериальной гипертензии.
6. Классификация гипертонической болезни.
7. Тактика лечения гипертонической болезни.
8. Профилактика артериальной гипертензии.
ЭТАЛОНЫ ОТВЕТОВ НА ВОПРОСЫ
ДЛЯ КОНТРОЛЯ ИСХОДНОГО УРОВНЯ ЗНАНИЙ.( II уровень).
1. Термин «артериальная гипертензия» предложил E.Frank в 1911г. (essenctial hypertention). В 1922 г. Bergmann в Германии ввел понятие «Krankheit Bluthochdruck» (болезнь высокого кровяного давления), а в России в это же время Г.Ф.Ланг – термин «гипертоническая болезнь» (ГБ).
В настоящее время под АГ понимают состояния, кардинальным признаком которых является повышение АД до уровня 140/90 мм.рт.ст., причем превышение данного параметра должно быть зафиксировано не менее 3 раз и не быть связанным с сиюминутной ситуацией (так называемая реакция на белый халат).
2. Все АГ делятся по происхождению на две большие группы: первичная АГ и симптоматическая АГ. Первичная, которую чаще называют эссенциальной («основной», «сущностной»), является заболеванием неизвестной этиологии, не связанной с каким-то конкретным заболеванием сердечно-сосудистой системы или других органов (еще одно название – идиопатическая АГ). Со времен E.Frank и до наших дней этот термин широко используется в медицинской литературе. Предложенное Г.Ф.Лангом наименование «Гипертоническая болезнь» получило широкое распространение в СССР и России. В 1962г. по предложению А.Л.Мясникова Комитет экспертов ВОЗ принял решение считать синонимами термины «эссенциальная гипертензия» и гипертоническая болезнь. Тем не менее в нашей стране используются оба термина, что создает некоторое неудобство для практических врачей, поэтому унификация понятия необходима. Следует использовать термин «гипертоническая болезнь» (данное состояние именно «болезнь», а не просто повышение АД неизвестной этиологии).
САГ является не самостоятельным заболеванием, а лишь симптомом патологии почек, эндокринной системы, неврологических заболеваний, поражения сосудов и т.д., с чем, однако, не согласен Б.И.Шулутко (1998г), усматривающий в наследственном ослаблении медуллярно-депрессорной функции почек причину возникновения любых АГ.
3. ФАКТОРЫ РИСКА РАЗВИТИЯ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНИ.
Наследственность.
Наследственная отягощенность является наиболее доказанным фактором риска и хорошо выявляется у родственников больного близкой степени родства (особое значение имеет наличие ГБ у матерей больных). Речь идет, в частности, о полиморфизме гена АПФ. А также о патологии клеточных мембран (Ю.Постнов). этот фактор не обязательно приводит к возникновению ГБ. По-видимому, генетическая предрасположенность реализуется через воздействие внешних факторов.
Масса тела.
У лиц с избыточной массой тела АД выше. Эпидемиологические исследования убедительно показали прямую корреляцию между массой тела и величиной АД. При избыточной массе тела риск развития ГБ увеличивается в 2-6 раз (индекс Кетле, представляющий собой отношение массы тела к росту, выраженному в м2, превышает 25; окружность талии > 85 см у женщин и >98см у мужчин). С фактором избыточной массы тела связывают более частое развитие ГБ в индустриально развитых странах.
Метаболический синдром (синдром Х).
Характеризуется андроидным ожирением, инсулинорезистентностью, гиперинсулинемией, нарушением липидного обмена (низкий уровень ЛПВП) – положительно коррелирует с повышением АД.
Потребление алкоголя
САЛ и ДАД у лиц, ежедневно употребляющих алкоголь. Соответственно на 6,6 и 4,7 мм.рт.ст выше, нежели у лиц, употребляющих алкоголь лишь один раз в неделю.
Потребление соли
Во многих экпериментальных, клинических и эпидемиологических исследованиях показана связь между высотой АД и ежедневным потреблением поваренной соли.
Физическая активность
У лиц, ведущих сидячий образ жизни, вероятность развития АГ на 20-50% выше, чем у физически активных людей.
Психосоциальный стресс
Установлено, что острая стрессорная нагрузка приводит к повышению АД. Предполагается, что и длительный хронический стресс также ведет к развитию ГБ. Вероятно, имеют большое значение и особенности личности больного. Обстоятельные исследования последних лет (1998, 1999), проведенные S/Paterniti и соавт., Lovallo и соавт., Piccirillo и соавт., позволили определить особенности личности больных, страдающих ГБ. Это:
1. Высокая степень ответственности, высокие требования, которые больной предъявляет к себе и окружающим
2. Высокая степень эмоциональности
3. Амбивалентная зависимость больного от значимых фигур в его окружении (в сочетании с гипертрофированной потребностью во внимании, любви, со страхом потерять это внимание и любовь)
4. Фрустрированная потребность в доминировании над значимыми фигурами в своем окружении
5. Повышенная тенденция реагировать «агрессией» на фрустрацию
6. Равносильная тенденция подавлять «агрессивные» эмоции (в том числе, связанные с фрустрацией).
В процессе эволюции ГБ проходит ряд этапов, на которых имеются определенные морфологические изменения:
- Период так называемых функциональных нарушений (морфологические изменения на субклеточном уровне).
- Период патологических изменений в артериолах и артериях (выявляемых более «грубыми» методами).
- Период вторичных изменений в органах.
Скорость развития морфологических изменений и тяжесть поражения органов-мишеней во многом зависит не только (и не столько) от «гипертонического стажа», сколько от рациональной антигипертензивной терапии. Если для первого периода характерна лишь неравномерность калибра мелких артерий и артериол, то для 2-го и 3-го – гипертрофия миокарда левого желудочка, дистрофические изменения и миокардиофиброз. В крупных артериях развивается атеросклероз, увеличивается проницаемость стенок мелких и средних артерий, в них возникают дистрофические изменения с развитием гиалиноза, фиброза и артериолосклероза. Изменения сосудов носят системный характер. Поражение почечных артерий приводит к запустеванию нефронов, уменьшению почек в размерах и появлению первично-сморщенной почки (гипертонический нефроангиосклероз).
Поражение при АГ мелких артерий и артериол, т.е. сосудов сопротивления (резистивных), отчетливо связано с отсутствием лечения. Современная антигипертензивная терапия предупреждает структурное ремоделирование левого желудочка и сосудов, фатальные церебральные и кардиальные осложнения, снижает массу миокарда гипертрофированного левого желудочка.
4. ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНИ.
АД – один из гибких механизмов, регулирующих течение метаболических процессов. В свою очередь, оно существенно зависит от их особенностей. На АД влияет характер обменных реакций (в периоды физической, психической активности, сна и отдыха) в связи с чем его величина колеблется в пределах суток, т.е. этот показатель не является жесткой гомеостатической константой и находится в прямой зависимости от активности анаболических и катаболических реакций.
Как известно, величина АД зависит от соотношения минутного объема сердца (МОС), синонимом которого является сердечный выброс (СВ), и общего периферического сопротивления сосудов (ОПСС). Ударный объем сердца (УОС) определяет уровень АД, тонус периферических (в первую очередь – резистивных) сосудов, обусловливает величину ДАД.
В классических работах К.Венцлера и А.Богера впервые было показано, что причиной АГ является увеличение СВ, при этом авторы отмечали нормальное ОПСС. Г.Ф.Ланг, в отличие от К.Венцлера и А.Богера, считал, что развитие АГ прежде всего определяется повышением тонуса резистивных сосудов: в начале болезни – вследствие спазма, в последующем – в силу их структурных изменений. Эти данные, по мнению Н.Н.Савицкого, дали основание поставить 2 вопроса: являются ли варианты заболеваний, при которых увеличено ОПСС или повышен СВ, разными формами ГБ? В какой степени тип гемодинамики согласуется с клиническими проявлениями болезни? Отвечая на них, Н.Н.Савицкий выделил 3 гемодинамических типа циркуляции при ГБ:
- Гиперкинетический
- Эукинетический
- Гипокинетический.
Им было высказано предположение, что у конкретного больного в течение жизни тип центральной гемодинамики не изменяется.
ГБ может быть следствием 5 вариантов нарушения центральной гемодинамики (М.С.Кушаковский, 1982):
 1 тип – ОПСС , МОС – N (50-60% больных);
1 тип – ОПСС , МОС – N (50-60% больных);
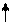
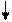

 2 тип – МОС , ОПСС – N ;
2 тип – МОС , ОПСС – N ;
3 тип – МОС , ОПСС - ;
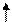
 4 тип – МОС , ОПСС - ;
4 тип – МОС , ОПСС - ;


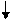 5 тип – МОС , ОПСС - .
5 тип – МОС , ОПСС - .
У здоровых лиц повышение либо снижение АД при различной интенсивности обменных процессов обусловлено изменениями взаимодействия прессорной и депрессной систем.
К прессорной системе относят:
ü Симпатико-адреналовую систему (САС);
ü Ренин-ангиотензин-альдостероновую систему (РААС);
ü Систему антидиуретического гормона (вазопрессина);
ü Систему прессорных простагландинов (тромбоксан А2, простагландин F2а);
ü Систему эндотелинов
Депрессорная система включает:
ü Барорецепторы сино-каротидной зоны аорты;
ü Калликреин-кининовую систему;
ü Системы депрессорных простагландинов (А, Д, Е2, простациклин I2)
ü Предсердный натрийуретический фактор;
ü Эндотелийзависимый фактор релаксации (ЭФР).
Данные системы не являются в функциональном отношении антагонистами. Так, выявлена значительная гетерогенность и разнонаправленность действия различных типов α- и β-адренорецепторов. В пределах системы простагландинов имеются как вазоконстрикторные (простагландин F2а, тромбоксан А2), так и вазодилятаторные (простациклин, простагландин Е2) субстанции.
Эндотелиальная система состоит из прессорных компонентов (эндотелины) и депрессорных (ЭФР). При ГБ взаимодействие прессорной и депрессорной систем рассогласовано – вначале прессорные влияния перевешивают депрессорные, затем доминируют над ними.
Наиболее сложен вопрос о том, что является в генезе ГБ пусковым механизмом (механизмами?), нарушающим оптимальное взаимодействие компонентов прессорной и депрессорной систем. М.С.Кушаковский (1995) склоняется к мнению, что эссенциальная АГ (ГБ) является полиэтиологичной и полипатогенетичной.
Предпочтение, возможно, следует отдать хорошо известной «мозаичной» теории патогенеза ГБ, выдвинутой I.Page (1979): все узлы предложенной им фигуры – октаэдра - реактивность, эластичность, калибр сосуда, вязкость, СВ, нервные и химические влияния, объем внутрисосудистой жидкости – тесно взаимосвязаны. Они определяют соотношение МОС и ОПСС и, как следствие, - тканевую перфузию, которая зависит от выраженности обменных процессов в каждый определенный момент времени.
Для начальных этапов развития ГБ характерна активация САС, увеличение уровня катехоламинов в крови и их суточной экскреции с мочой. У здоровых людей увеличение АД ведет к снижению активности САС, в то время как при АГ гиперадренергия и увеличение АД становятся однонаправленными процессами, что, возможно, связано с генетическими дефектами и нарушением барорецепторного контроля с отсутствием подавления активности САС либо с нарушением чувствительности сосудов к норадреналину.
В результате активации САС включается ряд механизмов, обусловливающих увеличение АД:
- Периферическая веноконстрикция с увеличением венозного возврата крови к сердцу и ростом ударного выброса;
- Повышение ЧСС, что в сочетании с возрастанием УОС ведет к увеличению СВ (и последующему повышению САД);
- Стимуляция β1 – рецепторов периферических артериол, ведущая к спазму резистивных сосудов и росту ОПСС (обусловливающего повышение ДАД).
На фоне гиперадренергии отмечается сужение сосудов почек и увеличение в ответ на возникающую ишемию выработки ренина в клетках ЮГА. Существует мнение, что катехоламины могут стимулировать клетки ЮГА без предшествующей ишемии. Известно, что под влиянием прямой стимуляции β-адренорецепторов возможно повышение уровня ренина без изменениея тонуса сосудов почек. В свете сказанного блокада β1 – рецепторов (β-адреноблокаторами) вполне целесообразна.
Выработка ренина запускает каскад превращений ангиотензина I (AI), который под воздействием ангиотензинпревращающего фермента (АПФ) трансформируется в один из самых мощных прессорных факторов ангиотензина II – AII. Было выявлено существование двух типов рецепторов к AI-II-АТ1 и АТ2: АТ1 – рецепторы ответственны за вазоконстрикцию, задержку натрия и воды; АТ2 – рецепторы связаны с вазодилятацией, увеличением диуреза и выведением натрия.
Увеличение количества AII стимулирует выработку в надпочечниках альдостерона, минералокортикоида, обусловливающего задержку натрия и воды с увеличением массы циркулирующей крови. Параллельно отмечается выработка антидиуретического гормона гипофиза. (вазопрессина), обладающего вазаконстрикторным действием и вызывающего задержку жидкости в организме.
В начальной стадии ГБ увеличивается скорость почечного кровотока, отмечается гиперфильтрация, что позволяет при необходимости быстро экскретировать избыток жидкости и ионов натрия. В последующем развивается дисфункция почек, при которой для удаления из организма избытка соли и воды уже необходимо повышение системного АД. В зависимости от активности ренина плазмы было выделено 3 формы ГБ: нормо-, гипо- и гиперрениновая. При первых двух формах концентрация альдостерона в крови близка к нормальной, при третьей уровень альдостерона растет пропорционально активности ренина (J.Laragh, 1973).
В последние годы получены интересные данные об «автономных» тканевых РААС, причем именно активность этих систем ведет к разрастанию кардиомиоцитов, клеток мышечного слоя артерий и артериол, процессам склерозирования и фиброзирования. В свете сказанного вполне оправдано применение средств, которые препятствовали бы превращению AI в AII, а с другой стороны – средств, могущих блокировать рецепторы к AII (а именно рецепторы АТ1).
Ю.В.Постнов и С.Н.Орлов (1987) предложили теорию, согласно которой генетически детерминированная патология транспорта ионов через полупроницаемые мембраны способствует избыточному накоплению ионизированного кальция в цитозоле мышечных волокон, что является еще одним компонентом периферической вазоконстрикции, повышения ОПСС и, соответственно, роста ДАД. С этих позиций оправдано применение средств, препятствующих накоплению ионов кальция в кардиомиоците и гладкомышечных клетках сосудов, - так называемых антагонистов кальция. (АК).
Обсуждая патогенез ГБ, нельзя не коснуться эндотелиальной системы. Сосудистый эндотелий еще недавно рассматривался лишь как слой клеток, выстилающий сосуды изнутри. В настоящее время известно, что эндотелиальные клетки вырабатывают целый спектр веществ, осуществляющих локальную регуляцию кровотока. Эндотелиальная система - самая крупная система организма человека. Эндотелий «переводит» химические, механические и другие сигналы на язык, «понятный» гладкомышечным клеткам сосудов. Сосудистый эндотелий, по образному выражению J.Vane (1996), - «маэстро циркуляции».
При АГ возникает дисфункция эндотелия с превалированием констрикции сосудов. Эндотелиальные клетки в избытке вырабатывают прессорные агенты – эндотелины, которые совместно с АII и тромбоксаном опосредуют вазоконстрикторные эффекты, подавляя вазодилатирующее влияние эндотелиального фактора релаксации (NO) и простагландинов. Формируется «порочный круг» (circulus vitiosus): чем выше АД и стабильнее АГ, тем больше она закрепляется эндотелийзависимыми факторами. В этом состоит кардинальное значение эндотелиальной дисфункции в патогенезе ГБ. Естественно, что восстановление функции эндотелия представляется перспективным направлением в лечении АГ, тем более, что уже имеются препараты, которые наряду с β-адреноблокирующими обладают и вазодилятирующими свойствами вследствие стимуляции продукции NO (небиволол).
Таким образом, при развитии ГБ (эссенциальной АГ) преобладание компонентов прессорной системы на тканевом и клеточном уровне (эндотелиальная дисфункция, увеличение активности тканевых РААС, генетически обусловленная патология клеточных мембран) сочетается со снижением системных депрессорных влияний (ослаблении барорецепторного контроля, «перенастройка» барорецепторов синокаротидной зоны, снижение выработки кининов и депрессорных простагландинов и простациклина, предсердного натрийуретического фактора и ингибитора ренина). Если вовремя не начать рациональную антигипертензивную терапию, начинает развиваться ремоделирование гладкомышечных клеток медии сосудов и миокарда левого желудочка, поражение сосудов сетчатки, головного мозга и почек. Поражение органов-мишеней и «поведение» АД определяют течение, прогноз и исход ГБ.
Длительное воздействие повышенного АД на сердечно-сосудистую систему (наряду с многокомпонентным воздействием различных биологически активных субстанций) является причиной развития столь многочисленных вторичных изменений органов и систем, что ГБ (эссенциальная АГ) у многих больных часто производит впечатление довольно однородной группы расстройств (B.Folkow, E.Neil, 1976). Приведенные сведения о патогенезе ГБ показывают, что это впечатление обманчиво. Вероятно, пройдет не слишком много времени, и мы станем свидетелями «расщепления» ГБ (эссенциальной АГ) на ряд вполне самостоятельных заболеваний, как это случилось с хроническими диффузными заболеваниями печени, почек и другими видами патологии.
5. ВЫЯВЛЕНИЕ И ПОДТВЕРЖДЕНИЕ АРТЕРИАЛЬНОЙ ГИПЕРТОНИИ.
В связи с высокой спонтанной вариабельностью АД диагноз гипертонии должен основываться на данных многократных измерений АД в разной обстановке.
Во время визита к врачу в большинстве случаев можно ограничиться измерением АД в положении пациента сидя по стандартной методике. У пожилых больных и больных сахарным диабетом рекомендуется измерение АД в положении лежа и стоя. Приборы для измерения АД следует регулярно калибровать и тестировать с помощью ртутного сфигмоманометра.
АГ диагностируют, если систолическое АД составляет 140 мм.рт.ст. и более, диастолическое 90мм.рт.ст. и более у лиц, не принимающих антигипертензивных препаратов. В качестве критерия диагностики и эффективности лечения следует в равной мере использовать уровни систолического (САД) и диастолического (ДАД) АД.
По мере накопления эпидемиологических данных о естественном течении заболевания стало очевидным постоянно повышение риска сердечно-сосудистой заболеваемости и летальности с повышением АД. Однако четко разграничить нормальный и патологический уровень АД оказалось невозможным. Риск осложнений повышается при увеличении АД даже в пределах нормы. При этом абсолютное большинство сердечно-сосудистых осложнений регистрируется у лиц с небольшим повышением АД.
В последней классификации ВОЗ устранены понятия о мягкой, умеренной, тяжелой формах АГ, которые часто не соответствуют долговременному прогнозу. Введено понятие «степень АГ», отражающее именно уровень повышения АД, вместо понятия «стадия», которое подразумевает прогрессирование состояния во времени. Установление «истинной» степени повышения АД возможно при впервые выявленной или нелеченной АГ.
Уровень АД оценивается на основании средних значений не менее двух измерений АД во время не менее двух визитов с интервалами 2 мес после первого выявления повышенного АД. В случае повышения АД 2-3-й степени тактика ведения больного определяется врачом в соответствии с конкретной клинической ситуацией.
Измерение АД в домашних условиях.
Измерение АД в домашних условиях позволяет получить ценную дополнительную информацию как при первичном обследовании пациента, так и при дальнейшем контроле эффективности лечения.
При измерении АД в домашних условиях можно оценить его в различные дни в условиях повседневной жизни пациентов и устранить «эффект белого халата». Самоконтроль АД дисциплинирует пациента и улучшает приверженность лечению. Измерение АД дома помогает точнее оценить эффективность лечения и потенциально снизить его стоимость.
Данные ряда исследований показали, что уровень АД, измеренного дома, ниже уровня АД, измеренного в клинике: уровень измеренного дома АД 125/80мм.рт.ст. соответствует 140/90мм.рт.ст при измерении в клинических условиях. Важным фактором, влияющим на качество самостоятельного контроля АД пациентами, является использование приборов, соответствующих международным стандартам точности. Не рекомендуется применять аппараты для измерения АД на пальце или запястье. Следует строго придерживаться инструкции об измерении АД при использовании автоматических электронных приборов.
Суточное мониторирование АД.
В настоящее время все более широкое распространение получают неинвазивные автоматические приборы для длительной регистрации АД в амбулаторных условиях. Рекомендуемая программа суточного мониторирования АД предполагает регистрацию АД с интервалами 15 мин в период бодрствования и 30мин в период сна. Ориентировочные нормальные значения АД в период бодрствования составляют 135/95мм.рт.ст., в период сна – 120/70мм.рт.ст. со степенью снижения АД в ночные часы 10-20%. АГ диагностируют при среднесуточном АД 135/85 мм.рт.ст. и выше, в период бодрствования 140/90мм.рт.ст. и выше, в период сна 125/75 мм.рт.ст. и выше.
Имеются многочисленные данные о более тесной корреляции поражения органов-мишеней (гипертрофия левого желудочка, тяжесть ретинопатии, микроальбуминурия, уровень креатинина в сыворотке крови) при АГ и данными суточного мониторирования АД по сравнению с разовыми измерениями. Показано, что динамика уровня среднесуточного АД сильнее коррелирует с регрессом поражения органов-мишеней, в частности гипертрофии левого желудочка, чем изменение АД при традиционных клинических измерениях.
Сегодня суточное мониторирование АД не является обязательным методом исследования больных АГ. Его следует считать необходимым в приведенных ниже ситуациях:
· Необычные колебания АД во время одного или нескольких визитов;
· Подозрение на «гипертонию белого халата» у больных с низким риском сердечно-сосудистых заболеваний;
· Симптомы, позволяющие заподозрить наличие гипертонических эпизодов;
· АГ, рефрактерная к медикаментозному лечению;
6. КЛАССИФИКАЦИЯ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНИ ПО ПОРАЖЕНИЯМ ОРГАНОВ-МИШЕНЕЙ.
Дата добавления: 2015-01-01; просмотров: 274; Мы поможем в написании вашей работы!; Нарушение авторских прав |