
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Характеристика электрона четырьмя квантовыми числами.
Основная характеристика, определяющая движение электрона в поле ядра,— это его энергия. Энергия электрона, как и энергия частицы светового потока — фотона, принимает не любые, а лишь определенные дискретные, прерывные или, как говорят, квантующиеся значения.
Движущийся электрон обладает тремя степенями свободы перемещения в пространстве (соответственно трем координатным осям) и одной дополнительной степенью свободы, обусловленной наличием у электрона собственного механического и магнитного моментов, которые учитывают вращение электрона вокруг своей оси. Следовательно, для полной энергетической характеристики состояния электрона в атоме необходимо и достаточно иметь четыре параметра. Эти параметры получили название квантовых чисел. Квантовые числа, так же как и энергия электрона, могут приникать не все, а лишь определенные значения. Соседние значения квантовых чисел различаются на единицу. Главное квантовое число n характеризует общий запас энергии электрона или его энергетический уровень. Главное квантовое число может принимать значения целых чисел от 1 до  . Для электрона, находящегося в поле ядра главное квантовое число может принимать значения от 1 до 7 (соответственно номеру периода в периодической системе, в котором находится элемент). Энергетические уровни обозначаются или цифрами в соответствии со значениями главного квантового числа, или буквами: Если, например, n=4, то электрон, находится на четвертом, считая от ядра атома, энергетическом уровне, или на N уровне. Физический смысл квантовых чисел- Характеризуют положение электронов в атоме,их атомные орбитали: удаленность от ядра, энергию электрона, форму орбиталей, пространственную ориентацию орбиталей, веретенообразное вращение электрона вокруг собственной оси - "спин".Данными значениями квантовых числе n,l,ml,ms может характеризоваться только один электрон(Принцип Паули).
. Для электрона, находящегося в поле ядра главное квантовое число может принимать значения от 1 до 7 (соответственно номеру периода в периодической системе, в котором находится элемент). Энергетические уровни обозначаются или цифрами в соответствии со значениями главного квантового числа, или буквами: Если, например, n=4, то электрон, находится на четвертом, считая от ядра атома, энергетическом уровне, или на N уровне. Физический смысл квантовых чисел- Характеризуют положение электронов в атоме,их атомные орбитали: удаленность от ядра, энергию электрона, форму орбиталей, пространственную ориентацию орбиталей, веретенообразное вращение электрона вокруг собственной оси - "спин".Данными значениями квантовых числе n,l,ml,ms может характеризоваться только один электрон(Принцип Паули).
5. Правило Клечковского: порядок заполнения энергетических состояний определяется стремлением атома к минимальному значению суммы главного и побочного квантовых чисел, причем в пределах фиксированного значения n + l в первую очередь заполняются состояния, отвечающие минимальным значениям n.
1. Применение правила Клечковского для калия (Z = 19) и скандия (Z = 21).
Предшествующий калию элемент аргон (Z = 18) имеет следующее распределение электронов по орбиталям: 1s22s22p63s23p6.
При распределении электронов по орбиталям в атоме К в соответствии с правилом Клечковского предпочтение отдается орбитали 4s (сумма квантовых чисел n + l равна 4 + 0 = 4) по сравнению с орбиталью 3d (сумма квантовых чисел п + l равна 3 + 2 = 5), как орбитали, имеющей минимальное значение n + l
Следовательно, для атома К: 1s22s22p63s23p64s1
6. 1) Современная формулировка периодического закона: "свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов". Структура периодической Системы Д. И. Менделеева. Периодическая система Д. И. Менделеева подразделяется на семь периодов – горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера, и восемь групп – последовательностей элементов обладающих однотипной электронной конфигурацией атомов и сходными химическими свойствами. Первые три периода называются малыми, остальные – большими. Первый период включает два элемента, второй и третий периоды – по восемь, четвёртый и пятый – по восемнадцать, шестой – тридцать два, седьмой (незавершённый) – двадцать один элемент. Каждый период (исключая первый) начинается щелочным металлом и заканчивается благородным газом. Элементы 2 и 3 периодов называются типическими. Малые периоды состоят из одного ряда, большие – из двух рядов: чётного (верхнего) и нечётного (нижнего). В чётных рядах больших периодов расположены металлы, и свойства элементов слева направо изменяются слабо. В нечётных рядах больших периодов свойства элементов изменяются слева направо, как у элементов 2 и 3 периодов. В периодической системе для каждого элемента указывается его символ и порядковый номер, название элемента и его относительная атомная масса. Координатами положения элемента в системе является номер периода и номер группы. Элементы с порядковыми номерами 58-71, именуемыми лантаноидами, и элементы с номерами 90-103 - актиноиды – помещаются отдельно внизу таблицы. Группы элементов, обозначаемые римскими цифрами, делятся на главные и побочные подгруппы. Главные подгруппы содержат 5 элементов (или более). В побочные подгруппы входят элементы периодов, начиная с четвёртого. Химические свойства элементов обуславливаются строением их атома, а точнее строением электронной оболочки атомов. Сопоставление строения электронных оболочек с положением элементов в периодической системе позволяет установить ряд важных закономерностей: 1. Номер периода равен общему числу энергетических уровней, заполняемых электронами, у атомов данного элемента. 2. В малых периодах и нечётных рядах больших периодов с ростом положительного заряда ядер возрастает число электронов на внешнем энергетическом уровне. С этим связано ослабление металлических и усиление неметаллических свойств элементов слева направо. Номер группы, указывает число электронов, которые могут участвовать в образовании химических связей (валентных электронов). В подгруппах с ростом положительного заряда ядер атомов элементов усиливаются их металлические и ослабляются неметаллические свойства. Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется. Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения их атомов, а именно числом электронов на их внешних энергетических уровнях. По числу энергетических уровней в электронной оболочке атома элементы делятся на семь периодов. Первый период состоит из атомов, в которых электронная оболочка состоит из одного энергетического уровня, во втором периоде — из двух, в третьем — из трех, в четвертом — из четырех и т. д. Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень. В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем Уровне имеют 2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов. Далее мы видим, что внешние электронные оболочки сходны у атомов элементов (Li, Na, К, Rb, Cs); (Ве, Mg, Са, Sr); (F, Сl, Вг, I); (Не, Nе, Аг, Kr, Хе) и т. д. Именно поэтому каждая из вышеприведенных групп элементов оказывается в определенной главной подгруппе периодической таблицы: Li, Na, К, Rb, Cs в I группе, F, Сl, Вг, I — в VII и т. д. Именно вследствие сходства строения электронных оболочек атомов сходны их физические и химические свойства. Число главных подгрупп определяется максимальным числом элементов на энергетическом уровне и равно 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов. Поскольку в периодической системе химических элементов Д. И. Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам (так называемые триады Fe-Со-Ni, Ru-Rh-Pd, Os-Ir-Pt), то число побочных подгрупп, так же как и главных, равно 8. По аналогии с переходными элементами число лантаноидов и актиноидов, вынесенных внизу периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на f-подуровне, т. е. 14. Период начинается элементом, в атоме которого на внешнем уровне находится один s-электрон: в первом периоде это водород, в остальных — щелочные металлы. Завершается период благородным газом: первый — гелием (1s2), остальные периоды — элементами, атомы которых на внешнем уровне имеют электронную конфигурацию ns2np6.
7.В зависимости от состояния электронов в атомах различают s-, p-, d-, f-орбитали и соответствующие им s-, p-, d-, f-подуровни. В зависимости от того, какой подуровень (s, p, d или f) заполняет очередной электрон, соответственно различают s-, p-, d- или f-элементы. В главных подгруппах ПСХЭ Д.И.Менделеева находятся s- и р-элементы, а в побочных подгруппах – d- и
f-элементы.
s-, p-, d-, f-элементы, их расположение в периодической системе. Первый период состоит из двух элементов: водорода и гелия. Атомом гелия заканчивается формирование K-оболочки атома, обозначим ее [Не]. Электрон, который последним заполняет орбитали атома, называется формирующим, и элемент относится к группе, называемой по формирующему электрону. В данном случае оба элемента имеют формирующие s-электроны и соответственно называются s-элементами У элементов второго периода формируется L-оболочка, заполняются s- и p-подоболочки. Формирующими электронами у первых двух элементов являются s-электроны, поэтому Li и Be относятся к s-элементам. Остальные шесть элементов периода входят в число р-элементов, так как формирование их орбиталей заканчивается p-электроном. У элемента Ne полностью заполнена 2р-подоболочка, обозначим его электронную конфигурацию как [Ne].Третий период начинается с натрия, электронная конфигурация которого 1s22s22p63s1 и заканчивается аргоном с электронной конфигурацией 1s22s22p63s23p6[Аr]. Хотя в третьем уровне (оболочка М) имеется подоболочка 3d которая остается незаполненной, в четвертом периоде начинает формироваться следующая оболочка N (n=4) и период начинается с s-элемента калия, [Аr]4s1. Это обусловлено тем, что энергия подуровня 4s несколько ниже, чем энергия подуровня 3d (см. рис. 1.5). В соответствие с правилом Клечковского n+1 у 4s(4) ниже, чем n+1 у 3d(5). После заполнения 4s-подоболочки заполняется 3d-подоболочка. Элементы от Sc [Ar] 3d1 4s2 до Zn [Ar] 3d |04s2, имеющие формирующие d-электроны, относятся к d-элементам. Как видно из табл. 1.3, у хрома на 4s-подоболочке остается один электрон, а на 3d-подоболочке вместо четырех оказывается пять d-электронов. Такое явление получило название «провала» электрона с s- на d-подоболочку. Это обусловлено более низкой энергией конфигурации 3d54s] по сравнению с конфигурацией 3d44s2. «Провал» электронов наблюдается и у других атомов, например у атомов Си, Nb, Mo, Pt, Pd Четвертый период завершается формированием подоболочки 4р у криптона [Аг] 3d104s24p6 или [Кг]. Всего в четвертом периоде 18 элементов. Пятый период аналогичен четвертому периоду. Он начинается с s-элемента рубидия [Кг] 5s1 и заканчивается p-элементом ксеноном [Кr] 4d105s25p6 или [Хе] и включает в себя десять 4d-элементов от иттрия до кадмия. Всего в пятом периоде 18 элементов. В шестом периоде, как и в пятом, после заполнения s-подоболочки начинается формирование d-подоболочки предвнешнего уровня у лантана. Однако, у следующего элемента энергетически выгоднее формирование 4f-подоболочки по сравнению с 5d-подоболочкой. Поэтому после лантана следует 14 лантаноидов с формирующими f-электронами, т.е.f-элементов от церия Се [Хе] 4f25d°6s2 до лютеция Lu [Хе] 4f145dl6s2. Затем продолжается заполнение оставшихся орбиталей в 5d-подоболочке и 6p-подоболочке. Период завершает радон [Хе] 4f145d°6s26p6 или [Rn]. Таким образом период имеет 32 элемента: два s-элемента, шесть p-элементов, десять d-элементов и четырнадцать элементов. Седьмой период начинается и продолжается аналогично шестому периоду, однако формирование его не завершено. Он также имеет вставную декаду из d-элементов и четырнадцать 5/элементов (актиноидов)
8.Принцип Паули-В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами. Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так: В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Хотя бы одно из квантовых чисел n, l, ml и ms, должно обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2 другой c ms = -1/2 . Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml. Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml=0 и ms может иметь произвольные значения: +1/2 или -1/2 . Мы видим, что если n = 1, таких электронов может быть только два. В общем случае, при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l, принимающим значения от 0 до n 1. При заданных n и l может быть (2l + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l и ml соответствуют два разных значения проекции спина ms. Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой 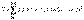 Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т.д. Рассмотрим, например, атом гелия. В атоме гелия 2He квантовые числа n = 1, l = 0 и ml = 0 одинаковы для обоих его электронов, а квантовое число ms отличается. Проекции спина электронов гелия могут быть ms = +1/2 или ms = -1/2 . Строение электронной оболочки атома гелия 2Не можно представить как 1s2 или, что то же самое
Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т.д. Рассмотрим, например, атом гелия. В атоме гелия 2He квантовые числа n = 1, l = 0 и ml = 0 одинаковы для обоих его электронов, а квантовое число ms отличается. Проекции спина электронов гелия могут быть ms = +1/2 или ms = -1/2 . Строение электронной оболочки атома гелия 2Не можно представить как 1s2 или, что то же самое 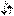 Заметим, что в одной квантовой ячейке согласно принципу Паули никогда не может быть двух электронов с параллельными спинами. Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1s, а только в состоянии 2s:
Заметим, что в одной квантовой ячейке согласно принципу Паули никогда не может быть двух электронов с параллельными спинами. Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1s, а только в состоянии 2s:  Правило Гунда-При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных p-орбиталях:
Правило Гунда-При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных p-орбиталях: 
В этом случае суммарный спин равен 3/2 , поскольку его проекция равна ms = +1/2-1/2+1/2=1/2 . Эти же три электрона не могут быть расположены таким образом: 
потому что тогда проекция суммарного спина ms = +1/2-1/2+1/2=1/2 . По этой же причине именно так, как приведено выше, расположены электроны в атомах углерода, азота и кислорода. Рассмотрим далее электронные конфигурации атомов следующего третьего периода. Начиная с натрия 11Nа, заполняется третий энергетический уровень с главным квантовым числом n = 3. Атомы первых восьми элементов третьего периода обладают следующими электронными конфигурациями: Определение валентности в нормальном и возбужденном состояниях- Валентность – это способность атома присоединять или замещать определенное число других атомов. Единицей валентности принята валентность атома водорода. Хотя в настоящее время есть некоторые трудности определения понятия валентности, тем не менее это понятие используется. Атомы щелочных металлов в нормальном состоянии имеют спин S=1/2, и соответственно валентность
9. 1) А́ТОМНЫЕ РА́ДИУСЫ, характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Под эффективным радиусом атома или иона понимается радиус сферы его действия, причем атом (ион) считается несжимаемым шаром. Используя планетарную модель атома, его представляют как ядро, вокруг которого по орбиталям вращаются электроны. Последовательность элементов в Периодической системе Менделеева соответствует последовательности заполнения электронных оболочек. Эффективный радиус иона зависит от заполненности электронных оболочек, но он не равен радиусу наружной орбиты. Для определения эффективного радиуса представляют атомы (ионы) в структуре кристалла как соприкасающиеся жесткие шары, так что расстояние между их центрами равно сумме радиусов. Атомные и ионные радиусы определены экспериментально по рентгеновским измерениям межатомных расстояний и вычислены теоретически на основе квантово-механических представлений. Размеры ионных радиусов подчиняются следующим закономерностям: 1. Внутри одного вертикального ряда периодической системы радиусы ионов с одинаковым зарядом увеличиваются с возрастанием атомного номера, поскольку растет число электронных оболочек, а значит, и размер атома. 2. Для одного и того же элемента ионный радиус возрастает с увеличением отрицательного заряда и уменьшается с увеличением положительного заряда. Радиус аниона больше радиуса катиона, поскольку у аниона имеется избыток электронов, а у катиона – недостаток. Например, у Fe, Fe2+, Fe3+ эффективный радиус равен 0,126, 0,080 и 0,067 нм соответственно, у Si4-, Si, Si4+ эффективный радиус равен 0,198, 0,118 и 0,040 нм. Изменение атомных радиусов в периодической системе носит периодический характер. В периодах атомные и ионные радиусы по мере увеличения заряда ядра в общем уменьшаются. Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, так как у них происходит заполнение внешнего квантового слоя. В больших же периодах в пределах семейств d - и / - элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называется соответственно d - и f - сжатием.
10. В настоящее время ПЗ формулируется: свойства хим. элементов, а также форма и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов. Каждый из периодов (исключая первый) начинается типичным металлом (щелочной группы) и заканчивается инертным газом.
В периоде, с увеличением заряда ядра наблюдается изменение св-в от металлических к типично неметаллическим, что связано с увеличением числа е на внешнем энергетическом уровне.
В Группах объединены элементы, имеющие сходное е строение внешнего эн. уровня. Эл-ты аналоги (в 1 группе) проявляют схожие хим. св-ва. Т.о., при послед. увеличении зарядов атомных ядер периодически повторяется конфигурация ЭО и, как следствие, периодически повторяются хим. св-ва элементов. В этом заключается физ. смысл периодического закона.
Номер группы, как правило, указывает на число е, способных участвовать в образовании хим. связей (валентные электроны). – физический смысл номера группы.
Важнейшие характеристики атомов: размеры, энергия ионизации, сродство к электрону, электроотрицательность.
Атомные радиусы - Орбитальные радиусы атомов изменяются периодически. В периодах, по мере роста заряда ядер ОР уменьшаются (при одинаковом числе эн. уров. в периоде возрастает заряд ядра, а след., и притяжение е к ядру.). В группах с ростом заряда ядер ОР атомов увеличиваются. В главных подгруппах такое увел. происх. в большей степени.
Сродство к е атома – энергия, которая выделяется (или затрачивается) при присоединении в нейтральному атому е с образованием отрицательного иона: Э+е->Э*- + Е, в кДж/моль.Сродство к е считают положительным, если присоед. сопр. выделением Е и наоборот. Зависит от е стр-ры атома. Наибольшим сродством обладают Эл. гр. VIIA (галогены). В подгруппах сверху вниз уменьшается, но не всегда монотонно.
Электроотрицательность. Это способность атома в молекуле или сложном ионе притягивать к себе е, учавствующие в образовании хим. связи.
В периоде ЭО аозрастает с увеличением порядкового номера, а в группе, как правило, убывает по мере увеличения ядра. Т.о. наим эо – s-эл. 1-ой группы, наиб. – p-эл-ты 6, 7 групп. . Энергия ионизации (Y) - энергия, которая обычно затрачивается для отрыва 1-го электрона от нейтрального атома. характеризует восстановительные свойства атомов (т.е. отдают свои (e)). Потенциал ионизации –разность потенциалов, под воздействием которой е обретает Е, соотв. Е ионизации, измеряют в вольтах. A - 1(e) -> A+ - (Y); [Y] = Кдж/моль. Чем меньше Y тем он более восстановительные свойства проявляет.
Дата добавления: 2015-01-01; просмотров: 595; Мы поможем в написании вашей работы!; Нарушение авторских прав |