
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Sp2-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 3 (примеры).
Атомы углерода в sp2-гибридном состоянии образуют такие аллотропные формы как графит, графен, фуллерены (например, C60-фуллерен, 77 Кб [Library of 3-D Molecular Structures]) и другие наноструктуры. sp2-Гибридизация характерна для атомов С, N, O и др. с двойной связью (sp2-атомы выделены красным цветом): H2C=CH2 (анимация, 21,3 Кб), H2C=CHR, R2C=NR, R-N=N-R, R2C=O, R-N=O, а также для катионов типа R3C+ и свободных радикалов R3C•.
15) Эндотерми́ческие реа́кции (от др.-греч. ἔνδον — внутри и θέρμη — тепло) — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения (  ,
,  ), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты. К эндотермическим реакциям относятся: реакции восстановления металлов из оксидов, электролиза (поглощается электрическая энергия), электролитической диссоциации (например, растворение солей в воде), ионизации, фотосинтеза. Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится сэнергией связи
), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты. К эндотермическим реакциям относятся: реакции восстановления металлов из оксидов, электролиза (поглощается электрическая энергия), электролитической диссоциации (например, растворение солей в воде), ионизации, фотосинтеза. Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится сэнергией связи
Горение топлива в кислороде воздуха. Горение пороха. Добавление концентрированной серной кислоты в воду. Окисление жиров и углеводов в живых организмах. Адиабатическое горение Термодина́мика (греч. θέρμη — «тепло», δύναμις — «сила») — раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника. 1-й закон — первое начало термодинамики: Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как  где
где 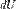 есть полный дифференциал внутренней энергии системы, а
есть полный дифференциал внутренней энергии системы, а  и
и  есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно. Нужно учитывать, что
есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно. Нужно учитывать, что  и
и  нельзя считать дифференциалами в обычном смысле этого понятия, поскольку эти величины существенно зависят от типа процесса, в результате которого состояние системы изменилось. Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
нельзя считать дифференциалами в обычном смысле этого понятия, поскольку эти величины существенно зависят от типа процесса, в результате которого состояние системы изменилось. Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:  где
где  — подведённое к телу количество теплоты, измеренное в джоулях
— подведённое к телу количество теплоты, измеренное в джоулях  [1] — работа, совершаемая телом против внешних сил, измеренная в джоулях Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
[1] — работа, совершаемая телом против внешних сил, измеренная в джоулях Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV  Энтальпия — величина аддитивная (экстенсивная), т. е. для сложной системы равна сумме энтальпий её независимых частей
Энтальпия — величина аддитивная (экстенсивная), т. е. для сложной системы равна сумме энтальпий её независимых частей  . Подобно другим термодинамическим потенциалам, энтальпия определяется с точностью до постоянного слагаемого, которому в термодинамике часто придают произвольные значения (например, при расчете и построении тепловых диаграмм). При наличии немеханических сил величина энтальпии системы равна
. Подобно другим термодинамическим потенциалам, энтальпия определяется с точностью до постоянного слагаемого, которому в термодинамике часто придают произвольные значения (например, при расчете и построении тепловых диаграмм). При наличии немеханических сил величина энтальпии системы равна  где
где 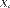 — обобщённая сила;
— обобщённая сила;  — обобщённая координата. Термохимические уравнения Химические уравнения, в которых указан тепловой эффект называются термохимическими уравнениями. 1/2H2(г) + 1/2Cl2(г) = HCl(г) DH = -92 кДж (*) Zn(к) + H2SO4(р) = ZnSO4(р) + Н2(г) DН = -163.2 кДж 1) Знак теплового эффекта - если тепло выделяется, внутренняя энергия системы уменьшается (-), для эндотермических процессов (+). 2) При написании термохимических уравнений необходимо указывать агрегатное состояние вещества, поскольку переход из одного агрегатного состояния в другое также сопровождается тепловым эффектом. Пишем либо (г), (ж), (тв), либо газ - формула берется в круглые скобки (Cl2), жидкость не обозначается, твердые вещества в квадратных скобках [Zn]. 3) DH зависит от количества вещества, поэтому важно уравнивать реакции, при этом коэффициенты могут быть дробными . Уравнение (*) можно записать и так (H2) + (Cl2) = 2(HCl), но тогда DH’ = 2DH. 4) DН зависит от условий - от температуры и давления. Поэтому обычно приводятся стандартные значения DНo
— обобщённая координата. Термохимические уравнения Химические уравнения, в которых указан тепловой эффект называются термохимическими уравнениями. 1/2H2(г) + 1/2Cl2(г) = HCl(г) DH = -92 кДж (*) Zn(к) + H2SO4(р) = ZnSO4(р) + Н2(г) DН = -163.2 кДж 1) Знак теплового эффекта - если тепло выделяется, внутренняя энергия системы уменьшается (-), для эндотермических процессов (+). 2) При написании термохимических уравнений необходимо указывать агрегатное состояние вещества, поскольку переход из одного агрегатного состояния в другое также сопровождается тепловым эффектом. Пишем либо (г), (ж), (тв), либо газ - формула берется в круглые скобки (Cl2), жидкость не обозначается, твердые вещества в квадратных скобках [Zn]. 3) DH зависит от количества вещества, поэтому важно уравнивать реакции, при этом коэффициенты могут быть дробными . Уравнение (*) можно записать и так (H2) + (Cl2) = 2(HCl), но тогда DH’ = 2DH. 4) DН зависит от условий - от температуры и давления. Поэтому обычно приводятся стандартные значения DНo
16) Энтальпия образования (теплота образования), энтальпия реакции образования данного вещества (или раствора) из заданных исходных веществ. Энтальпией образования химических соединения называют энтальпию реакции образования данного соединения из простых веществ. В качестве простых веществ выбирают химические элементы в их естественном фазовом и химическом состоянии при данной температуре. Так, при 298 К для хлора простым веществом служит газообразный хлор, состоящий из молекул С12, а для калия - металлический калий. Энтальпия образования твердого КСl при 298 К - это энтальпия реакции: К(тв.) + 1/2Сl2= КСl(тв.). Энтальпия образования КСl (тв.) при 500 К соответствует реакции: К(жидкий) + 1/2Cl2 = КСl(тв.), так как естественным фазовым состоянием (простым веществом) для калия становится уже не кристалл, а жидкость (т-ра плавления К 336,66 К). Энтальпия образования может быть определена при любой температуре. Стандартные энтальпии образования  соответствуют реакциям образования, при которых и простые вещества, и получающееся соединение находятся придавлении
соответствуют реакциям образования, при которых и простые вещества, и получающееся соединение находятся придавлении
 = 0. Для большинства хим. соед. энтальпия образования- отрицат. величины. Единицы измерения энтальпии образования - Дж/г, Дж/моль. Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Следствия из закона Гесса Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа). Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
= 0. Для большинства хим. соед. энтальпия образования- отрицат. величины. Единицы измерения энтальпии образования - Дж/г, Дж/моль. Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Следствия из закона Гесса Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа). Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):  Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν): 
17) 2-й закон — второе начало термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии. Приведем второе начало термодинамики в ещё одной формулировке Рудольфа Юлиуса Клаузиуса (1865): для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния  , называемая энтропией, такая, что ее полный дифференциал
, называемая энтропией, такая, что ее полный дифференциал  .
.
Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе. Физичесикй смысл энтропии мера беспорядка в системе формула ббольцмана с равна кА умн элндаблю
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:  Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Понятие энергии Гиббса широко используется в термодинамике и химии. В термодинамике вводится новая функция, связывающая две предыдущие величины –энергия Гиббса.(G) G = H – TS Основная ценность этой функции заключается в том, что ее изменение при постоянной температуре и давлении определяет самопроизвольность процессов ?G =(? H – T?S) <0 В классической термодинамике под энтропией понимают такое свойство системы, изменение которого при обратимом процессе численно равно отношению теплоты к температуре протекания процесса: ?S =Q/T; T?S=Q В термодинамике обратимым называют такой процесс, который проводится бесконечно медленно и так, чтобы система находилась все время практически в состоянии равновесия.
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Понятие энергии Гиббса широко используется в термодинамике и химии. В термодинамике вводится новая функция, связывающая две предыдущие величины –энергия Гиббса.(G) G = H – TS Основная ценность этой функции заключается в том, что ее изменение при постоянной температуре и давлении определяет самопроизвольность процессов ?G =(? H – T?S) <0 В классической термодинамике под энтропией понимают такое свойство системы, изменение которого при обратимом процессе численно равно отношению теплоты к температуре протекания процесса: ?S =Q/T; T?S=Q В термодинамике обратимым называют такой процесс, который проводится бесконечно медленно и так, чтобы система находилась все время практически в состоянии равновесия.
Дата добавления: 2015-01-01; просмотров: 289; Мы поможем в написании вашей работы!; Нарушение авторских прав |