
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Типы окислительно-восстановительных реакций
Все химические реакции, в которых электроны переходят от одного вещества или его части (восстановителя) к другому веществу или к другой части одного и того же вещества (окислителю), называются окислительно-восстановительными, или редокспроцессами. Любому веществу-окислителю (ox1) соответствует восстановленная форма (red1), а восстановителю (red2) – окисленная форма (ox2), вместе они образуют сопряженную окислительно-восстановительную пару (полуреакцию): 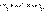
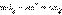 Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию:
Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию: 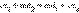 Если передача электронов от восстановителя к окислителю происходит во всем объеме раствора, то энергия химического взаимодействия рассеивается в окружающую среду в виде тепла (ΔH < 0). В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования. В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2. В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества: Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
Если передача электронов от восстановителя к окислителю происходит во всем объеме раствора, то энергия химического взаимодействия рассеивается в окружающую среду в виде тепла (ΔH < 0). В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования. В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2. В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества: Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
26 Электродный потенциал. Ряд напряжений металлов. Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металломи раствором электролита). Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически. Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
| Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au |
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах. В частности, пользуясь злектрохимическим рядом напряжения металлов, можно определить, какие металлы вытесняют другие из растворов их солей (Более активные, - те, которые левее, вытесняют менее активные). Какие металлы будут реагировать с разбавленным раствором серной кислоты, соляной кислотой и некоторыми другими. (Это металлы, стоящие в ряду напряжения до Н)
27 Гальванические элементы Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Гальванические элементы, единичные ячейки химических источников тока, предназначенных для однократного электрического разряда (непрерывного или прерывистого). После разряда гальванические элементы, в отличие отаккумуляторов, теряют работоспособность. Иногда термин "гальванические элементы" применяют и для обозначения единичных ячеек аккумуляторных батарей, которые предназначены для многократного использования, то есть после разряда могут быть снова заряжены. Главные составные части гальванические элементы: два электрода различной природы и электролит. Обычно электроды - это металлические пластинки или сетки, на которые нанесены реагенты ("активные вещества"); на отрицательный электрод - восстановитель (Zn, Li и др.), на положительный - окислитель (оксиды Mn, Hg и др., а также соли). На каждом из электродов, погруженных в электролит, устанавливается определенный потенциал (окислительно-восстановительный потенциал данной электродной реакции); разность этих потенциалов в отсутствие тока называют напряжением разомкнутой цепи (НРЦ). При соединении электродов между собой с помощью внешней электрической цепи электроны начинают перетекать от отрицательного электрода к положительному - возникает электрический ток. Суммарная электрохимическая реакция на обоих электродах. называется токообразующей; по мере ее протекания восстановитель отдает, а окислитель присоединяет электроны. Ток прекращается при размыкании внешней цепи, а также после израсходования запаса хотя бы одного из реагентов. Побочные химические или электрохимические реакции приводят к саморазряду гальванические элементы, ограничивающему длительность их хранения, которая для лучших образцов может достигать 10 лет. Гальванические элементы применяют главным образом для питания переносной аппаратуры (например, транзисторных радиоприемников) и поэтому изготавливают преимущественно с невыливающимся электролитом (загущенным или твердым). В отличие от аккумуляторов, гальванические элементы не нуждаются в особом уходе при эксплуатации. Наиболее распространены марганцево-цинковые элементы (окислитель - МnО2, восстановитель - Zn) с солевым электролитом (р-р NH4Cl и др.) или щелочным (раствор КОН). Для них НРЦ 1,5-1,8 В, удельная энергия 10-80 Вт-ч/кг. Стоимость элементов сравнительно невелика, и их мировое производство достигает 8-10 млрд. штук в год. Элементы со щелочным электролитом дороже, но обладают лучшими характеристиками, особенно при низких температурах и повышенных токах разряда.
Дата добавления: 2015-01-01; просмотров: 272; Мы поможем в написании вашей работы!; Нарушение авторских прав |