
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уравнение Нернста. ЭДС гальванического элемента.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. 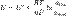 где
где  — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;  — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);  — абсолютная температура;
— абсолютная температура;  — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;  — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;  и
и 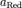 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции. Электродвижущая сила гальванических элементов может быть подсчитана по уравнению изотермы реакции Вант-Гоффа. Таким способом легко выводится известное уравнение Нернста. В обратимом гальваническом элементе электрическая энергия получается за счет химической энергии. Приравняем эту величину к величине электрической энергии гальванического элемента. Электродвижущая сила гальванического элемента зависит от химического состава электролита и электродов, а также от температуры элемента и давления в нем. Применим второй закон термодинамики к обратимому гальваническому элементу. Электродвижущая сила гальванического элемента зависит от химических и физических свойств веществ, его составляющих, и не зависит ни от формы и размеров элемента, ни от его внутреннего устройства. Но внутреннее устройство и размеры отдельных частей элемента имеют большое влияние на его внутреннее сопротивление, так как оно зависит от расстояния между полюсами ( при уменьшении этого расстояния внутреннее сопротивление элемента уменьшается), от размера погруженной в жидкость поверхности полюсов ( при увеличении этой поверхности внутреннее сопротивление уменьшается), от химического состава жидкости элемента. Внутреннее сопротивление гальванических элементов не является постоянным и по мере работы элемента оно постепенно возрастает. Электродвижущая сила гальванического элемента равна разности его электродных потенциалов: Е - Et - Ег, где Е - электродвижущая сила элемента, а Е1 и Еа - электродные потенциалы. Абсолютное значение электродного потенциала измерить нельзя, но можно определить электродвижущую силу гальванического элемента, составленного из двух электродов, причем потенциал одного из них условно принять равным нулю. Безусловно, при этом измеряют не абсолютную величину электродного потенциала, а его относительное значение. В качестве электрода с нулевым потенциалом принят нормальный водородный электрод ( рис. 75), представляющий собой пластинку с нанесенной на нее мелко раздробленной платиной ( платиновая чернь), погруженную в раствор серной кислоты. Электродвижущая сила гальванического элемента, составленного из водородного и насыщенного каломельного электродов при 25 С, равна 0 760 в. Электродвижущая сила гальванического элемента, составленного из насыщенного каломельного электрода и хингидронного электрода, заполненного исследуемым раствором при 18 С, равна 0 360 в. [6] Электродвижущая сила гальванического элемента из платины, серы, x - Ag2S и серебра оказалась равной нескольким тысячным вольта, вместо 0.2 в, которые должны были бы дать элемент, если бы он состоял из электролитов. Электродвижущая сила гальванических элементов, применяемых в опытах Б и Г, равна алгебраической сумме отдельных потенциалов, возникающих на границах раздела следующих фаз: медь раствор, цинк раствор и уголь серная кислота. Электродвижущая сила гальванического элемента Fe Fe2 OH - o2Pt составляет 1.235 В. Электродвижущая сила составленного гальванического элемента во время титрования изменяется точно так же, как и потенциал индикаторного электрода. Электродвижущую силу гальванических элементов измеряют с помощью так называемой компенсационной схемы. При этом ток в цепи исследуемого элемента равен нулю, что соответствует требованиям обратимости. Калиброванный пговод имеет одинаковое сечение по всей длине. Измерение электродвижущей силы гальванических элементов часто используется для определения средних коэффициентов активности электролитов. Величина электродвижущей силы гальванического элемента определяется только свободной стандартной энергией ( А / 70) токообразующего химического процесса и не зависит от конструкции источника электрической энергии и размера электродов. Величина электродвижущей силы гальванического элемента является мерой энергии окислительно-восстановительного процесса реакции замещения с металлами и измеряется разностью потенциалов между окислителем и восстановителем на полюсах гальванического элемента.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции. Электродвижущая сила гальванических элементов может быть подсчитана по уравнению изотермы реакции Вант-Гоффа. Таким способом легко выводится известное уравнение Нернста. В обратимом гальваническом элементе электрическая энергия получается за счет химической энергии. Приравняем эту величину к величине электрической энергии гальванического элемента. Электродвижущая сила гальванического элемента зависит от химического состава электролита и электродов, а также от температуры элемента и давления в нем. Применим второй закон термодинамики к обратимому гальваническому элементу. Электродвижущая сила гальванического элемента зависит от химических и физических свойств веществ, его составляющих, и не зависит ни от формы и размеров элемента, ни от его внутреннего устройства. Но внутреннее устройство и размеры отдельных частей элемента имеют большое влияние на его внутреннее сопротивление, так как оно зависит от расстояния между полюсами ( при уменьшении этого расстояния внутреннее сопротивление элемента уменьшается), от размера погруженной в жидкость поверхности полюсов ( при увеличении этой поверхности внутреннее сопротивление уменьшается), от химического состава жидкости элемента. Внутреннее сопротивление гальванических элементов не является постоянным и по мере работы элемента оно постепенно возрастает. Электродвижущая сила гальванического элемента равна разности его электродных потенциалов: Е - Et - Ег, где Е - электродвижущая сила элемента, а Е1 и Еа - электродные потенциалы. Абсолютное значение электродного потенциала измерить нельзя, но можно определить электродвижущую силу гальванического элемента, составленного из двух электродов, причем потенциал одного из них условно принять равным нулю. Безусловно, при этом измеряют не абсолютную величину электродного потенциала, а его относительное значение. В качестве электрода с нулевым потенциалом принят нормальный водородный электрод ( рис. 75), представляющий собой пластинку с нанесенной на нее мелко раздробленной платиной ( платиновая чернь), погруженную в раствор серной кислоты. Электродвижущая сила гальванического элемента, составленного из водородного и насыщенного каломельного электродов при 25 С, равна 0 760 в. Электродвижущая сила гальванического элемента, составленного из насыщенного каломельного электрода и хингидронного электрода, заполненного исследуемым раствором при 18 С, равна 0 360 в. [6] Электродвижущая сила гальванического элемента из платины, серы, x - Ag2S и серебра оказалась равной нескольким тысячным вольта, вместо 0.2 в, которые должны были бы дать элемент, если бы он состоял из электролитов. Электродвижущая сила гальванических элементов, применяемых в опытах Б и Г, равна алгебраической сумме отдельных потенциалов, возникающих на границах раздела следующих фаз: медь раствор, цинк раствор и уголь серная кислота. Электродвижущая сила гальванического элемента Fe Fe2 OH - o2Pt составляет 1.235 В. Электродвижущая сила составленного гальванического элемента во время титрования изменяется точно так же, как и потенциал индикаторного электрода. Электродвижущую силу гальванических элементов измеряют с помощью так называемой компенсационной схемы. При этом ток в цепи исследуемого элемента равен нулю, что соответствует требованиям обратимости. Калиброванный пговод имеет одинаковое сечение по всей длине. Измерение электродвижущей силы гальванических элементов часто используется для определения средних коэффициентов активности электролитов. Величина электродвижущей силы гальванического элемента определяется только свободной стандартной энергией ( А / 70) токообразующего химического процесса и не зависит от конструкции источника электрической энергии и размера электродов. Величина электродвижущей силы гальванического элемента является мерой энергии окислительно-восстановительного процесса реакции замещения с металлами и измеряется разностью потенциалов между окислителем и восстановителем на полюсах гальванического элемента.
29 Электролизов расплавов электролитов. Законы Фарадея.Электролиз – это окислительно восстановительные реакции, протекающие на электродах, если через раствор или расплав электролита пропускать постоянный электрический ток.При электролизе за счет электрической энергии протекают химические реакции – восстановление на катоде и окисление на аноде. Различают электролиз с инертными электродами (графитовые, угольные, платиновые) и активным анодом (растворимые), а также электролиз расплавов и растворов электролитов. Электролиз расплава электролита. При расплавлении соли и щелочи распадаются на ионы. Если через расплавы этих электролитов пропускать постоянный электрический ток, то ионы приобретают направленное движение, в результате на катоде восстанавливаются катионы металлов, а на аноде окисляются анионы.Рассмотрим схему электролиза расплав хлорида калия. При расплавлении хлорид натрия распадается на ионы K+ и CI- KCI ----- K+ + CI- При подключении электродов к источнику постоянного электрического тока ионы приобретают направленное движение – катионы K+ движутся к катоду и принимают от него электроны, анионы CI- - к аноду и отдают электроны. Зако́ны электро́лиза Фараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836 году Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах. Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Законы Фарадея можно записать в виде следующей формулы:  где:m — масса осаждённого на электроде вещества в граммахQ — полный электрический заряд, прошедший через веществоF = 96485,3383(83) Кл·моль−1 — постоянная ФарадеяM — молярная масса вещества z — валентное число ионов вещества (число электронов на один ион). Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
где:m — масса осаждённого на электроде вещества в граммахQ — полный электрический заряд, прошедший через веществоF = 96485,3383(83) Кл·моль−1 — постоянная ФарадеяM — молярная масса вещества z — валентное число ионов вещества (число электронов на один ион). Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Дата добавления: 2015-01-01; просмотров: 525; Мы поможем в написании вашей работы!; Нарушение авторских прав |