
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 2. Электронное строение.
Введение: обязательно нужна таблица электронных эффектов, помещена в голубой методичке в третьей теме. Все заместители до бензола называем электронодонорными и пишем как ЭД, после бензола – электроноакцепторными и называем ЭА. Сам бензол, сука такая, в разных ситуациях может проявлять свойства как ЭД, так и ЭА.
Типичные вопросы:
1. Истинность утверждений
Пример:

Смиритесь, дорогие любители химии, это безнадежно…
Как с этим бороться:
Никак, смиритесь, это не дано большинству студентов РНИМУ. Строить какие-то глобальные зависимости мне лень с моей стороны было бы безответственно без наличия у вас фундаментальной базы и знания теории Брёнстеда-Лоури, однако кратко могу написать некоторые верные утверждения:
- ЭД заместители понижают кислотность и усиливают основность,
- ЭА заместители напротив, усиливают кислотность и понижают основность,
- чем сильнее кислота, тем больше Ка, меньше рКа и меньше рН ее раствора,
- более сильной кислоте соответствует более слабое сопряженное основание,
- чем сильнее основание, тем больше Кв, меньше рКв, меньше Квн+, больше рКвн+, больше рН раствора,
- более сильному основанию соответствует более слабая сопряженная кислота.
-ЭД заместители повышают стабильность катионов и радикалов, понижают устойчивость анионов за счет делокализации отрицательного заряда.
-ЭА заместители повышают стабильность анионов, но понижают стабильность катионов и радикалов.
И не пытайтесь повторить это дома.
2. Виды гибридизации
Пример:

Узнали sp2 и sp3?
Как с этим бороться:
Легкий вопрос. Если у углерода все связи одинарные, а он сам какой нибудь СН3, то это sp3-гибридизация, если у углерода есть двойная связь, типа «СН2=СН-…» или бензольное кольцо, то это sp2-гибридизация Еще гибридизированы таким образом катионы, радикалы и анионы. Надо иметь в виду, что если вещество СН3-СН=СН2, то в нем есть и sp2-, и sp3-гибридизации. Но вообще, вы же сдавали ЕГЭ и наверняка разбираетесь в гибридизации? Там это проходят.
3. Виды сопряжений.
Пример:

Таки да, оба вида сопряжений
Как с этим бороться:
успокоиться, расслабиться, осознать, что все не так сложно, как вы пытаетесь это себе представить. Итак, сопряжения бывают р–π (читается как «пэ-пи») и
π–π (читается как «пи-пи», хе-хе). π-π сопряжения могут быть реализованы соседством двух двойных связей, разделенных одной одинарной, схематично х=х-х=х, х-любые атомы, возможно, даже и разные. Например, СН2=СН-СН=СН2 – классика π- π сопряжений, а СН2=СН-СН=О уже не классика, но тоже вариант. Частный случай π- π сопряжения – бензол. р- π сопряжения чуть сложнее, реализуются от соседства двойной связи и атома с неподеленной электронной парой (N, O, S, Cl, Br, I, С- внимание! да это С с минусом!), или атома с неспаренным электроном (С. это с с точкой наверху), или атома с пустой орбиталью (С+ атом С с плюсом). Схематично х=х-у, где х-это атомы углерода, а у-что нибудь из перечисленных атомов. Например СН2=СН-О-СН3. Внимание еще раз! Возможна реализация обоих видов сопряжения, например в анилине (привет, первая тема) – бензол сам по себе π- π сопряженная система, а бензол с атомом N – еще и р- π сопряжение образует.
4. Электронные эффекты заместителя.
Пример:
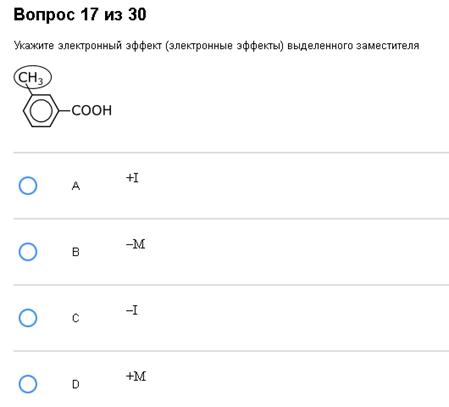
Классика-классика. +I. Вероятнее всего, очередной fail. По изначальному замыслу вопрос должен допускать несколько вариантов ответа, ведь у каждой (кроме алкила) группы есть оба эффекта (I и M)
Как с этим бороться:
Важнейшая тема. Для нее то как раз и нужна таблица заместителей. Итак, электронные эффекты бывают индуктивные (I) и мезомерные (М), и те, и другие бывают «+» и «-». Замес этого вопроса как раз и заключатся в том, чтобы узнать, когда какой знак. С индуктивными все просто, берем и смотри в таблице, у какого заместителя он какой. Нужно вам узнать индуктивный эффект у СН3 – берем и узнаем, что для СН3, как и для остальных алкильных радикалов (вы ведь в курсе, что СН3-алкильный радикал?) индуктивный эффект +I. Казалось бы, все просто? А вот хуй. Не торопитесь с выводами. Мезомерный эффект существует только в сопряженных системах. Вот, например, NH2. По таблице –I и +M. В молекуле СН3-NH2 нет системы сопряжения (см п. 3.), поэтому только –I. А вот в анилине система сопряжения будет, там будет и –I и +M.
5. Устойчивость частиц.
Пример:
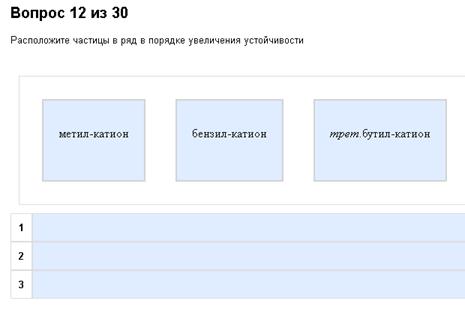
Номенклатура. Кто-нибудь знает, что такое трет.бутил-катион?

Опять fail. Не, ну правда, сколько можно косячить? И снова все дано названиями, а не формулами.
Как с этим бороться:
Как ни странно, но утверждения, данные в п. 1, имеют место применяться тут. Кратко – суть: есть катионы (+), радикалы (.), анионы (-). Устойчивость катионов и радикалов повышается ЭД-заместителями и понижается ЭА (смотрим таблицу, вспоминаем, что это). Катион или радикал без ничего – средне устойчив. Один СН3 - так себе, чуть лучше. Два СН3 - лучше. Три СН3 - совсем хорошо. Один СН=СН2 – намного лучше, чем даже три СН3. Один С6Н5 (то есть фенильный радикал, то есть гайка) – вообще заебись наиболее устойчивый радикал или катион. Всякая ЭА-хрень, типа СF3, С(=О), COOH, NO2 – снижает устойчивость катионов и радикалов. Пример правильного ряда: CH2+-COOH<СН3+<CH2+-CH3<CH+(CH3)2<C+(CH3)3<CH2+-CH=CH2<CH2+-C6H5. По анионам – все наоборот. ЭА – повышают устойчивость, ЭД – понижают. Чем больше С=О и СF3 находится рядом с катионом, тем он устойчивее. При этом следует, однако, иметь в виду нюанс: СН3-О- менее устойчив, чем С6Н5-О-. Фенил же более ЭД, чем метил, скажете вы. А такова двойственная природа фенила, отвечу я, где то он ЭД, а где то ЭА.
Зловещая суть фенила: в отношении катионов и радикалов он ЭД, в отношении анионов ЭА.
6. Уменьшение/увеличение кислотных/основных свойств в ряду.
Пример:

Хоть тут все правильно. Самое слабое основание – аминобензальдегид (гайка и альдегид – два ЭА заместителя, уменьшающие основность амина ниже плинтуса), сильнее – анилин (одна ЭА группа), еще сильнее – метиланилин (ЭА+ЭД заместители для амина) и самый сильный в ряду – метиламин (только ЭД).
Как с этим бороться:
То же, что и предыдущий вопрос, но со своей атмосферой. Итак. Кислоты – это ОН (спирт), SH (тиол) или СООН (карбоксильная группа), именно в таком порядке увеличивается их кислотность. Почти независимо от прочих факторов ОН<SH<СООН в смысле кислотности. На силу кислот влияют группы, прикрепленные к кислоте. Вы таки будете смеяться, но и тут есть смысл обратиться к п. 1. И, таки да, ЭД заместители понижают кислотность, а ЭА – ее повышают. Ну не чудо ли? Для примера – правильный ряд кислот по силе СН3-ОН < C6H5-OH* < O2N-C6H4-OH* < СН3-СООН < H-COOH < Cl-CH2-COOH < Cl2-CH-COOH < Cl3C-COOH.
(*- и снова фенил. Oн ЭД для катионов, радикалов, но для кислот-оснований – ЭА) Основаниями являются атомы N в аминогруппах, в отличие от кислот, тут без вариантов, что упрощает задачу. ЭД-повышают основность, ЭА-понижают, (фенил=ЭА для оснований).
Правильный ряд по силе оснований: O2N-C6H4-NH2 < C6H5-NH2 < NH3 < CH3-NH2 < (CH3)2NH
Дата добавления: 2015-01-01; просмотров: 746; Мы поможем в написании вашей работы!; Нарушение авторских прав |