
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способы выражения составов газообразных, жидких и твердых веществ и их смесей
Исходными реагентами, а также конечными продуктами могут быть вещества, находящиеся в твердом, жидком и газообразном состояниях. На практике используют различные способы выражения концентраций и составов, а также переход от одних единиц, характеризующих состав, к другим.
Для газообразных веществ масса их смеси определяется по формуле
 (12)
(12)
где V1, V2, …, Vi - объемы газообразных компонентов, л, м3; 22,4 – объем, который занимает 1 моль (кмоль) газа при нормальных условиях (Т = 273 К, Р = 101,3 кПа), л, м3; М1, М2, …, Мi - молярные массы газообразных компонентов, г/моль, кг/кмоль.
Средняя молярная масса газовой смеси (при аддитивности ее свойств) равна
Мсмеси =  (13)
(13)
Концентрацию компонентов газовых смесей выражают чаще всего в объемных долях  или объемных процентах
или объемных процентах  Объемная доля численно совпадает с молярной долей данного компонента.
Объемная доля численно совпадает с молярной долей данного компонента.
Зависимость между давлением P, объемом V и температурой Т (К) вещества в газообразном состоянии определяется уравнением состояния газа (уравнением Менделеева – Клапейрона):
PV = nRT =  RT, (14)
RT, (14)
где n – химическое количество газа, моль, кмоль; R – универсальная газовая постоянная, равная 8,314 Дж/(моль · К); m – масса газа, г, кг; М – молярная масса газа, г/моль, кг/кмоль.
Если газ объемом V находится при одних условиях (Р, Т) и необходимо определить его объем V1 или его массу при других условиях (Р1, Т1), то используют следующие формулы:
1) для расчета объема
 (15)
(15)
2) для расчета массы
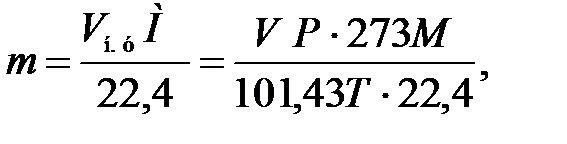 (16)
(16)
где V – объем газа при заданных условиях, м3; Vн. у – объем газа, приведенный к нормальным условиям, м3.
Раствор– однородная система переменного состава, содержащая два и большее число компонентов. Компонент, взятый в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке, – растворенным веществом.
В жидком состоянии реагенты и продукты чаще всего находятся в виде растворов. Для растворов необходимо знать их количественный состав, который может выражаться следующими способами:
- массовая доля растворенного вещества А (w(А));
- молярная концентрация С(А), моль/л.
- молярная концентрация эквивалента С  моль-экв/л;
моль-экв/л;
- молярная доля растворенного вещества N(А).
Массовая доля растворенного вещества – это величина, равная отношению массы вещества mА, кг, к массе раствора mр-ра, кг:
w(А) = 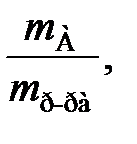 (17)
(17)
где mр-ра = mА + mр-ля.
Массовую долю выражают в долях единицы или в процентах (мас. %).
Молярная концентрация равна отношению химического количества растворенного вещества n(А), моль, к объему раствора V, л:
С(А) =  (18)
(18)
Химическое количество вещества выражается соотношением
n(А) = 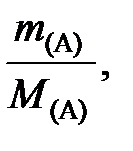 (19)
(19)
где m(А) – масса вещества А, г, кг; М(А) – молярная масса вещества А, г/моль, кг/кмоль.
Если известна масса m и плотность r раствора, то его объем V рассчитывается по формуле
V =  (20)
(20)
Молярная концентрация эквивалента (нормальная концентрация) равна отношению химического количества вещества эквивалента nэкв(А), моль, к объему раствора V, л:
С 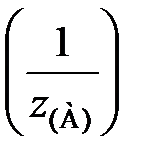 =
= 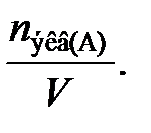 (21)
(21)
Химическое количество вещества эквивалента выражается соотношением
nэкв(А) =  (22)
(22)
Молярная долярастворенного вещества - это величина, равная отношению химического количества растворенного вещества к общему числу моль всех веществ в растворе:
N(А) =  (23)
(23)
Молярная доля выражается в долях единицы или в процентах (моль %).
Расчеты при разбавлении и смешении двух растворов В1 и В2 с содержанием растворенных веществ соответственно w1 и w2 удобно производить с помощью так называемого правила креста, наглядное представление о котором дает следующая схема [2]:
В1 w1 w - w2
w
В2 w2 w1 - w
В точке w пересечения прямых записывают содержание вещества в смешанном растворе w (мас. %). Содержание веществ в исходных смешиваемых растворах w1 и w2 (мас. %) указывают с левой стороны креста, причем w1 > w2. Разность w1 - w соответствует числу массовых частей раствора В2, необходимого для смешения с w - w2 частями раствора В1. При разбавлении раствора водой w2 = 0.
В химической промышленности широкое распространение получили процессы с использованием твердых веществ. Их состав чаще всего выражается:
1) в массовых долях  или массовых процентах
или массовых процентах 
2) в молярных долях (рассчитывается по формуле (23)).
Дата добавления: 2015-01-01; просмотров: 373; Мы поможем в написании вашей работы!; Нарушение авторских прав |