
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядок расчета.
Са(ОН)2 + СО2 = СаСО3¯
Са(ОН)2 + Са(НСО3)2 = 2СаСО3¯ + 2Н2О
2Na3РO4 + 3Са2+ = Са3(РO4)2¯ + 6Na+
2Na3РO4 + 3Mg2+ = Mg3(РO4)2¯ + 6Na+
Общая жескость воды, представляющая собой суммарное содержание ионов Са2+ и Mg2+ (ммоль/л), составит
Жо =  = 2,23 ммоль/л,
= 2,23 ммоль/л,
где 40 и 24 – молярные массы ионов Са2+ и Mg2+ соответственно, г/моль.
Временная жесткость рассчитывается исходя из содержания ионов НСО3-
Жв =  ∙
∙  =
=  ·
·  = 0,20 ммоль/л,
= 0,20 ммоль/л,
где 61 – молярная масса ионов НСО3-, г/моль;  - фактор эквивалентности ионов Са2+ и Mg2+, равный
- фактор эквивалентности ионов Са2+ и Mg2+, равный  .
.
Постоянная жесткость составит
Жп = Жо – Жв = 2,23 – 0,20 = 2,03 ммоль/л.
На устранение временной жесткости расходуется извести:
m  =
=  = 148 г.
= 148 г.
На удаление из воды СО2 затрачивается извести:
m  =
=  = 168 г.
= 168 г.
Масса известкового молока составит
mи.м.= 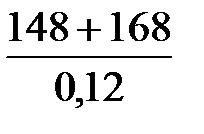 = 2634,8 г, или 2,63 кг.
= 2634,8 г, или 2,63 кг.
С помощью фосфата натрия проводится устранение постоянной жесткости. Масса фосфата натрия равна
m  =
=  = 2208,5 г, или 2,21 кг.
= 2208,5 г, или 2,21 кг.
Пример 11.Рассчитать жесткость воды после умягчения содовым способом и массу образующегося осадка, если объем воды составляет 150 м3, общая жесткость воды – 10 ммоль/л, концентрация ионов Mg2+ – 20 мг/л. Степень осаждения ионов Са2+ составляет 95%, Mg2+ – 98%.
Дата добавления: 2015-01-01; просмотров: 244; Мы поможем в написании вашей работы!; Нарушение авторских прав |