
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядок расчета. Молярная масса NH3 – 17 г/моль или кг/кмоль.
N2 + 3H2 ® 2NH3
Молярная масса NH3 – 17 г/моль или кг/кмоль.
Химическое количество аммиака составляет
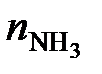 =
= 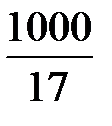 = 58,8 кмоль.
= 58,8 кмоль.
Поскольку из 1 кмоля азота образуется 2 кмоля аммиака, объем азота, вступающий в реакцию при получении 1 т NH3, равен
 прореаг = 58,8 ×
прореаг = 58,8 × 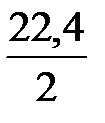 = 658,8 м3.
= 658,8 м3.
Рассчитаем практический объем азота, затрачиваемый на производство 1 т аммиака. С учетом содержания метана, равного 0,2 об. %, объем азотоводородной смеси без содержания метана составит
Vсмеси = 2800 ∙ (1 – 0,002) = 2794,4 м3.
Так как объем N2 составляет 0,25 от общего объема азотоводородной смеси, его объем на входе равен
VNвход = 2794,4 ∙ 0,25 = 698,6 м3.
Степень превращения азота в данном процессе составит
х =  × 100 =
× 100 =  × 100 = 94,2%.
× 100 = 94,2%.
Пример 3.Вычислить селективность процесса производства ССl4 по Сl2, если продукты реакций имеют следующий состав, об. %: ССl4 – 94, СНСl3 – 6.
Дата добавления: 2015-01-01; просмотров: 465; Мы поможем в написании вашей работы!; Нарушение авторских прав |