
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Хiмiчнi властивостi амiнокислот. Кольоровi реакцii. Солi i естери амiнокислот. Пептиди i пептони. Особливостi пептидного зв'язку.
1.Утворення внутрішніх солей 
2.Утворення солей з лугами або кислотами 
3.Утворення складних ефірів. 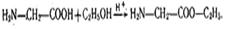
4.Декарбоксилування. 
5.Алкілування амінокислот. 
6.Утворення пептидів. 
Сполука, яка утворюється, називається пептидомГрупу —СО—NН— називають пептидною.
Якісні реакції на амінокислоти
1. Реакції з нінгідрином: При нагріванні з водним розчином нінгідрину вільні a-амінокислоти утворюють сполуки синього або фіолетового. Реакція характерна для аміногруп, що знаходяться в a-положенні й використовується для виявленняa-амінокислот, розділених хроматографічним методом.

2. Ксантопротеїнова реакція: Ксантопротеїнова реакція характерна для ароматичних амінокислот: тирозину, триптофану, фенілаланіну. Реакція зумовлена нітруванням бензольного кільця циклічних амінокислот та утворенням нітросполук жовтого кольору, який при додаванні аміаку переходить у оранжевий. Жовте забарвлення спостерігається у випадках, коли концентрована азотна кислота потрапляє на шкіру, нігті, які у великій кількості містять ці амінокислоти.
3. Реакція Фоля: Реакція Фоля відкриває сірковмісні амінокислоти цистин та цистеїн. Метіонін цієї реакції не дає тому, що сірка в ньому зв’язана метильною групою. У процесі кип’ятіння білка з лугом від цистеїну і цистину легко відщеплюється сірка у вигляді сірководню, який з ацетатом свинцю утворює осад сірчистого свинцю чорного або сірого кольору.
Пептон - препарат, отриманий з молока і м'яса тварин під дією протеолітичних ферментів .
На початкових стадіях процесу перетравлення білків під дією ферментів, наприклад, пепсину утворюються великі білкові фрагменти, які і називаються пептонами. Крім коротких пептидів, зазвичай пептони містить жири, метали, солі, вітаміни і багато інших органічних і мінеральних речовин.
Пептони широко використовуються для створення поживного середовища для вирощування бактерій і грибів
Утворення пептидного зв'язку
Пептидний зв'язок утворюється внаслідок реакції конденсації між карбоксильною і аміногрупою. При цьому аміногрупа відіграє роль нуклеофіла, заміщуючи гідроксил карбоксильної групи:
Оскільки -OH є поганою відхідною групою, описана реакція конденсації протікає дуже важко. Зворотна реакція — руйнування пептидного зв'язку — називається реакцією гідролізу.Реакція конденсації, внаслідок якої відбувається формування пептидного зв'язку, потребує вкладу вільної енергії
Функції бiлкiв. Класифiкацiя бiлкiв за будовою i геометричною формою молекули. Простi та складнi бiлки. Флавопротеiди, хромопротеїди, нуклеопротеїди, глiко‑, фосфо- та лiпопротеїди. Глобулярнi та фiбрилярнi бiлки.
. Їх класифікують переважно за фізико-хімічними властивостями та хімічним складом. За цими ознаками білки поділяють на дві групи – прості (протеїни) і складні (протеїди). Прості білки (протеїни) складаються тільки з залишків амінокислот; це лужні гістони та протаміни, рослинні нерозчинні проламіни та розчинні глутеліни, альбуміни та глобуліни, фібрилярні білки сполучної тканини (протеіноїди). Складні білки (протеїди) складаються з білкової (апобілок) та небілкової (простетична група, кофактор) частини. Це
фосфопротеїди (містять залишок ортофосфорної кислоти), металопротеїди (містять іони металів), гемопротеїди (містять гем), хромопротеїди (містять вітаміни), глікопротеїди (містять вуглеводи), ліпопротеїди (містять ліпіди), нуклеопротеїди (містять нуклеїнові кислоти
Залежно від фізико-хімічних властивостей, хімічного складу і значення розрізняють такі протеїни:
Альбуміни. Ці білки містяться в крові, лімфі, лікворі, насінні рослин, мікробах Добре розчиняються у воді і в розчинах солей. Виконують пластичні функції в тканинах і клітинах. До складу альбумінів входять лейцин (до 15%), лізин, аспарагінова і глутамінова кислоти, а також деяка кількість вуглеводів.
Глобуліни. За формою молекул глобуліни відносяться до глобулярних білків. До глобулінів належать міозин, тиреоглобулін, нейроглобулін, нейростромін.не розчиняються у воді
Гістонилегко розчиняються у воді, при додаванні аміаку осаджуються, мають основні властивостіДо складу гістонів входять аргінін, лізин, гістидин
Протаміни Знайдені в залозах внутрішньої секреції. Молекули протамінів побудовані в основному із залишків діаміномонокарбонових кислот, особливо багаті аргініном (до 70 – 87%). Мають основні властивості, утворюють солі з кислотами. При кип’ятінні не денатурують, легко розчиняються у воді
Глутеліни. Є важливими кормовими і харчовими білками. Містяться в зелених частинах рослин (до 43% складу білків) і зерні злаків. Розчиняються в розбавлених розчинах лугів і кислот. Молекули глутелінів багаті залишками глутамінової кислоти і лізину.
Протеїноїди (склеропротеїниПротеїноїди не розчиняються в холодній воді, розчинах лугів, кислот і солей, майже не розщеплюються протеолітичними ферментами, міцні і еластичні. В організмі виконують опорні функції. До них належать:
Колаген – фібрилярний протеїноїд. Колаген складає третину білків організму, є основним структурним компонентом сполучної тканини: сухожиль, зв'язок, хрящів, кісток, основи шкіри, луски риб.
Кератин – фібрилярний білок. Кератин складає основу епідермісу, волосся, шерсті, пір’я, рогів, копит, луски. Розчиняється у воді, розчинах кислот, лугів, солей і в органічних розчинниках
Еластин – опорний білок еластичних тканин. Складає білкову основу зв'язок, сухожиль, середньої оболонки великих артерій і вен. Еластин не розчиняється у воді навіть при кип’ятінні..
Фіброїн – білок шовкової нитки. Стійкий до гідролізу. Містить до 44% залишків гліцину, а також аланін і тирозин.
Протеїди розрізняють залежно від природи простетичної групи: нуклеопротеїди, хромопротеїди, фосфопротеїди, ліпопротеїди і глікопротеїди. Іноді до них відносять протеїдні комплекси.
Нуклеопротеїди. Складні білки, що складаються з простих білків і нуклеїнових кислот. Білкова частина нуклеопротеїдів найчастіше складається з гістонів або протамінів. Залежно від природи нуклеїнової кислоти розрізняють два види нуклеопротеїдів – дезоксирибонуклеопротеїди (ДНП) і рибонуклеопротеїди (РНП).
Хромопротеїди. Складні білки, молекула яких складається з простого білка і забарвленої простетичної групи
Гемоглобін – червоний залізовмісний білок крові. Його молекула складається з білка глобіну і забарвленої речовини гема, яка містить комплексно зв'язане залізо
Міоглобін. Молекула цього хромопротеїду утворена одним гемом і однією молекулою глобіну. Міститься в м'язовій тканині\
Фосфопротеїди. Молекули фосфопротеїдів при гідролізі розщеплюються до простих білків і ортофосфорної кислоти.
Казеїн – білок молока і молочних продуктів. Утворюється з казеїногена, від молекули якого при зсіданні відщеплюється пептид. Розчиняється в сольових розчинах, але не розчиняється у воді
Пепсин – основний фермент шлункового соку, найкраще діє в слабокислому середовищі. Розщеплює білки до пептидів
Ліпопротеїди. Це складні білки, молекула яких складається з простого білка і ліпіду. Ліпопротеїди розчиняються у воді і мало (або зовсім) не розчиняються в органічних розчинниках. Ліпопротеїди – основа біологічних мембран і пластинчатих структур
–Глікопротеїди.Молекули глікопротеїдів при гідролізі розщеплюються на простий білок і вуглеводну простетичну группу
Муцини – слизові виділення епітеліальних покривів слизових оболонок харчового каналу, дихальних і сечостатевих шляхів, слинних залоз\
Мукоїди – глікопротеїди хрящової і кісткової тканин
Дата добавления: 2015-01-19; просмотров: 1472; Мы поможем в написании вашей работы!; Нарушение авторских прав |