
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Рівняння Міхаеліса-Ментен
Виходячи із припущення, що лімітуючою стадією ферментативної реакції є розпад фермент-субстратного комплексу на вільний фермент і продукт, Міхаеліс та Ментен вивели рівняння, що описує гіперболічну криву залежності початкової швидкості від концентрації субстрату: (2)
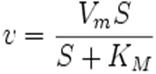
Наведене рівняння використовується тільки для односубстратних реакцій. Всі величини (V0, Vmax, Km та [S]) можна виміряти експериментально.
Загальні принципи та методи визначення одиниці виміру активності та кіл-ті ферментів Основними одиницями вимірювання активності є: міжнародна одиниця активності (МО), або стандартна одиниця - юніт (U): 1 МО відповідає такій кількості ферменту, яка каталізує перетворення 1 мкмоля субстрату за 1 хвилину при оптимальних умовах роботи ферменту (температури, рН, відсутність інгібіторів або активаторів); 2)катал – нова одиниця; 1катал(кат) відповідає такій кількості каталізатора, який перетворює 1 моль субстрату за 1 секунду.Кількість каталів визначають за формулою 3) для визначення кількості активних молекул ферменту в білковій масі використовують питому активність, яка дорівнює кількості одиниць активності ферменту в перерахунку на 1 мг білка: За результатами визначення питомої активності можна оцінити ступінь очищення ферменту від сторонніх білків – чим вища питома активність, тим менший вміст стороннього білка. 4) Молекулярна активність – кількість молекул субстрату, які перетворюються під дією однією молекули ферменту за 1 хвилину. Молекулярна активність дорівнює відношенню числа одиниць ферменту у зразку до кількості ферменту у мікромолях.
Шляхи та механізми регуляції ферментативних процесів: регуляція каталітичної активності ферментів; алостеричні ферменти, ковалентна модифікація ферментів 1. Алостерична регуляція характерна для особливих регуляторних (алостеричних) ферментів, які, крім активного, мають алостеричний ценр, що відповідає за зв’язування з модифікаторами (інгібіторами або активаторами). властивості алостеричних ферментів: алостеричні ферменти – це олігомерні білки; активний та алостеричний центри знаходяться на різних субодиницях. для алостеричних ферментів властивий кооперативний ефект Алостеричні взаємодії можуть бути гомотропні (лі-ганди ідентичні) і гетеротропні (ліганди різні).
Ізоферменти – це різновиди ферменту, які володіють однією і тією ж субстратною специфічністю, але відрізняються між собою деякими фізичними, хімічними, каталітичними та імунологічними властивостями. Молекула ізофермента складається з декількох субодиниць, які формують її четвертну структуру
Розрізняють оборотне і необоротне гальмування. Прикладом оборотного гальмування є дія антиферменту на ферментПрикладом необоротного гальмування є дія ізопропіл-фторфосфату на ацетилхолінестеразу.
Розрізняють два типи активації і гальмування ферментів: алостеричне або просторове, і субстратне або конкурентне.
Дата добавления: 2015-01-19; просмотров: 454; Мы поможем в написании вашей работы!; Нарушение авторских прав |