
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
Выражение для внутренней энергии газа Ван-дер-Ваальса найдем следующим образом. При расширении газа его молекулы совершают работу 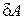 против сил молекулярного давления
против сил молекулярного давления  . Эта работа равна
. Эта работа равна
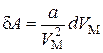 ,(3.7.1)
,(3.7.1)
где  – объем одного моля газа.
– объем одного моля газа.
С другой стороны, эта работа идет на увеличение потенциальной энергии взаимодействия молекул:
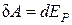 .(3.7.2)
.(3.7.2)
Из выражений (3.7.1–3.7.2) следует, что

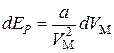 .(3.7.3)
.(3.7.3)
Интегрирование этого выражения дает
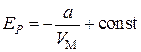 .(3.7.4)
.(3.7.4)
Внутренняя энергия 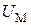 газа состоит из кинетической
газа состоит из кинетической 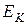 и потенциальной
и потенциальной 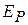 энергий, т. е.
энергий, т. е.
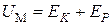 .(3.7.5)
.(3.7.5)
Подставим выражение (3.7.4) в (3.7.5).
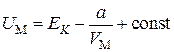 .(3.7.6)
.(3.7.6)
При 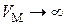 газ становится идеальным и его внутренняя энергия равна кинетической энергии движения молекул
газ становится идеальным и его внутренняя энергия равна кинетической энергии движения молекул 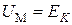 и равна, как мы знаем,
и равна, как мы знаем,  , т. е.
, т. е.
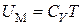 .(3.7.7)
.(3.7.7)
С другой стороны, при 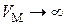 из (3.7.6)
из (3.7.6)
 .(3.7.8)
.(3.7.8)
Из сравнения выражений (3.7.7) и (3.7.8), заключаем, что 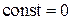 . Таким образом, из (3.7.6)
. Таким образом, из (3.7.6)
 .(3.7.9)
.(3.7.9)
Внутренняя энергия 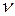 молей газа
молей газа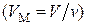
 ,(3.7.10)
,(3.7.10)
где V – объем, занимаемый 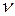 молями газа.
молями газа.
Рассмотрим изотермическое расширение газа Ван-дер-Ваальса от объема 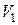 до объема
до объема 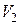 . Изменение внутренней энергии на основании (3.7.10)
. Изменение внутренней энергии на основании (3.7.10)
 .(3.7.11)
.(3.7.11)
Поэтому, согласно первому закону термодинамики, работа, произведенная газом Ван-дер-Ваальса при изотермическом расширении,

т. е. меньше количества полученного тепла, тогда как для идеального газа эта работа в точности равнялась количеству приобретенного тепла. Это объясняется тем, что в реальном газе при его изотермическом расширении часть тепла идет на работу против сил притяжения между молекулами, т. е. на увеличение потенциальной энергии молекул.
Рассмотрим далее адиабатное расширение газа Ван-дер-Ваальса без совершения внешней работы (так называемое расширение газа в вакуум). В этом случае в первом законе термодинамики необходимо положить 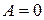 и
и  Тогда и
Тогда и  т. е.
т. е.
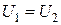 ,
,
и, учитывая выражение (3.7.10), последнее равенство можем переписать в виде:
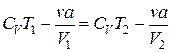 .
.
Откуда находим
 ,
,
так как  . Таким образом, газ Ван-дер-Ваальса при расширении в вакуум охлаждается. Охлаждение происходит потому, что в этом процессе часть кинетической энергии газа тратится на работу против сил притяжения между молекулами.
. Таким образом, газ Ван-дер-Ваальса при расширении в вакуум охлаждается. Охлаждение происходит потому, что в этом процессе часть кинетической энергии газа тратится на работу против сил притяжения между молекулами.
Дата добавления: 2015-04-18; просмотров: 1323; Мы поможем в написании вашей работы!; Нарушение авторских прав |