
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость химической реакци
С к о р о с т ь ю Г о м о г е н н о й р е а к ц и и называется количество
вещества п, вступающего в реакцию или образующегося в результате реакции за единицу времени t в
единице объема системы V:
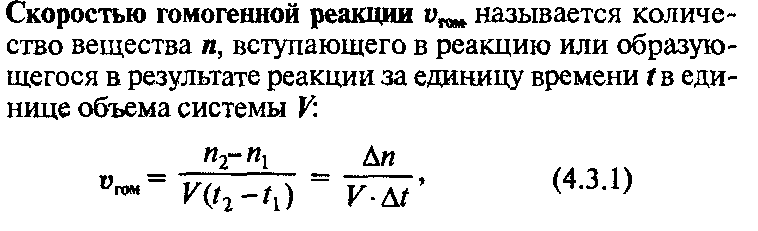
где щ — число молей реагирующего вещества в момент времени (х; пг — число молей этого же вещества в момент времени t2.
Отношение числа молей вещества к объему реакционной смеси я/ Vназывается мольно-объемной концентрацией, обозначается буквой Си выражается обычно в моль/д. Таким образом: 
Следовательно, скорость гомогенной реакции равна изменению концентрации какого-либо из реагирующих веществ в единицу времени и выражается в моль/л • с. Знак «+» в выражении 4.3.2 ставится в том случае, если С— концентрация какого-либо продукта реакции, а знак «—», если С — концентрация какого-либо исходного вещества (так как скорость реакции должна быть величиной положительной).
• СКОРОСТЬЮ ГЕТЕРОГЕННОЙ РЕАКЦИИ называется количество вещества, которое вступает в реакцию или образуется в результате реакции за единицу времени на единице поверхности раздела фаз S: 
Скорость любой химической реакции зависит от следующих факторов:
1)Природа реагирующих веществ.
2)Концентрация реагирующих веществ.
3)Температура.
4)Присутствие катализаторов.
Скорость гетерогенных реакций зависит также от:
а)величины поверхности раздела фаз (с увеличением поверхности раздела фаз скорость гетерогенных реакций увеличивается);
б)скорости подвода реагирующих веществ к поверхности раздела фаз и скорости отвода от нее продуктов реакции.
12.Зако́н де́йствующих масс
количественно зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс (Гульдберг и Вааге, Норвегия, 1867 г.):'
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для простейших одностадийных реакций концентрации веществ берутся в степенях, которые равны коэффициентам перед формулами веществ в уравнении реакции.
Например, для реакции аА + bВ = сС, + dD (где а, Ь, с, d — коэффициенты перед формулами веществ А, В, С, D) скорость реакции в соответствии с законом действующих масс равна:
v = к • [А]a • [В]b
где [А] и [В] — концентрации исходных веществ; к — константа скорости реакции, которая равна скорости реакции при концентрациях реагирующих веществ [А] = [В] = - 1 моль/л. Константа скорости реакции зависит от природы реагирующих веществ, температуры, но не зависит от концентрации веществ.
Выражения типа 4.3.4 называются кинетическими уравнениями реакций, В кинетические уравнения входят концентрации газообразных и растворенных веществ, но не входят концентрации твердых веществ:
2SO2(г) + O2(г) = 2SO3(г); v = k* [SO]2-[О2]
Дата добавления: 2015-04-18; просмотров: 293; Мы поможем в написании вашей работы!; Нарушение авторских прав |