
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Константа химического равновесия.
Отношение констант скоростей прямой и обратной реакций является величиной постоянной и называется константой равновесия
Концентрации твердых веществ в выражение константы равновесия не входят.
Константа равновесия данной реакции зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Присутствие катализатора также не влияет на константу равновесия; он одновременно увеличивает скорость прямой и обратной реакций, а поэтому только уменьшает время достижения равновесия.
Численное значение константы равновесия характеризует выход продуктов реакции. Чем больше Кр, тем полнее исходные вещества (А и В) превращаются в продукты реакции (С и D), т. е, тем больше выход продуктов реакции.
Химическое равновесие является подвижным При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение равновесия
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то говорят о смещении равновесия вправо Если скорость обратной реакции становится больше скорости прямой реакции, то говорят о смещении равновесия влево . Результатом смещения равновесия является переход системы в новое равновесное состояние с другим соотношением концентраций реагирующих веществ.
Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884 г.):
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Растворы как многокомпанентные системы.
Растворы – это однородные (гомогенные) дисперсные системы, состоящие из двух или большего числа компонентов (относительные количества которых могут меняться в широких пределах) и продуктов их взаимодействия.
Растворы занимают промежуточное положение между механическими смесями (растворы характеризуются непостоянством своего состава и могут быть разделены на составные части) и химическими соединениями (растворы однородны, устойчивы, образование растворов сопровождается энергетическим эффектом).
В настоящее время установлено, что при растворении молекулы растворяемого вещества связываются с молекулами растворителя, при этом образуются сольваты (если растворитель вода, то образуются гидраты). На разрушение связей между молекулами энергия затрачивается, а при образовании гидрата (сольвата) энергия выделяется; разница между этими энергиями будет наблюдаться в виде теплового эффекта растворения, которая может быть как положительной, так и отрицательной.
Растворитель (от латинского solvere, «ослабить») — жидкое, твёрдое или газообразное вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, которые растворяются в определённом объёме растворителя при заданной температуре. Обычно используются как органические растворители в химчистках (например,тетрахлорэтилен), как растворители (например, толуол, скипидар), для удаления лаков и клея (ацетон, метиловый спирт, этилацетат), в моющих средствах (цитрусовые терпены), в парфюмерии (этанол) и в химическом синтезе. Обычно растворитель и растворяемое вещество одинаковы по своей природе — подобное растворяется в подобном, то естьполярный растворитель подходит к полярному веществу. Например низшие спирты растворяются в высших.
Растворенное вещество – компоненты раствора за исключением растворителя.
20. Растворы газообразные, жидкие, твердые, идеальные. 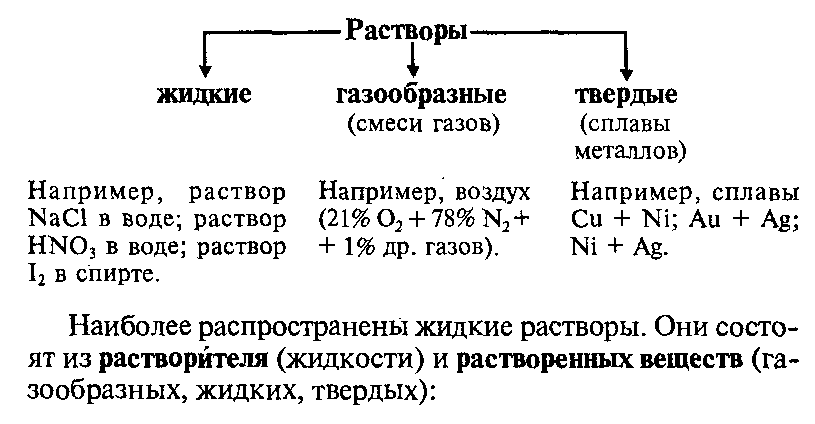

Дата добавления: 2015-04-18; просмотров: 803; Мы поможем в написании вашей работы!; Нарушение авторских прав |