
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Молекулярность и порядок реакции
Число молекул, вступающих в реакцию, определяют молекулярность реакции.
Так, если в реакцию вступает одна молекула, то такая реакция называется одномолекулярной реакцией. Если в реакции участвуют две молекулы (безразлично, одинаковые или нет), то такая реакция называется бимолекулярной. Встречаются также тримолекулярные реакции.
Мономолекулярные реакции H2S → H2 + S
Бимолекулярные реакции СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Молекулярность реакции легко определить в случае простых реакций, протекающих в одну стадию. В большинстве же случаев довольно трудно найти молекулярность реакции.
Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально.
Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции.
Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
H2 + I2 = 2HI.
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции.
Реакции –
- нулевого порядка – скорость не зависит от концентрации реагента;
- первого порядка – скорость прямо пропорциональна концентрации реагента, т.е. при изменении концентрации реагента в 2 разаскорость реакции увеличивается в 2 раза;
- второго порядка – при увеличении концентрации реагента в2 раза скорость реакции увеличивается в [2]2 = 4 раза, при увеличении концентрации в 3 раза скорость реакции увеличивается в [3]2 = 9раз, и т. д.;
- n-го – порядка – при увеличении концентрации в m раз скорость реакции возрастает в [m]n раз. Порядок реакции может такжевыражаться дробным числом и числом < 0. 
14. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
При повышении температуры на 10е скорость большнн ства химических реакций увеличивается в 2—4 раза.
Уравнение, которое описывает это правило следующее: 
где  — скорость реакции при температуре
— скорость реакции при температуре  ,
, 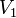 — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:

Дата добавления: 2015-04-18; просмотров: 336; Мы поможем в написании вашей работы!; Нарушение авторских прав |