
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергия активации. Влияние температуры на скорость хим. реакций. Уравнение Аррениуса.
Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea.
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
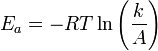
k — константа скорости реакции,  — фактор частоты для реакции,
— фактор частоты для реакции,  — универсальная газовая постоянная,
— универсальная газовая постоянная,  — температура в кельвинах.
— температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило Вант-Гоффа: повышение температуры на 10 К увеличивает для большинства реакций скорость в 2-4 раза.  .
.
Еа представляет собой избыток энергии (в расчете на 1 моль) по сравнению со средней Е молекул при данной Т, необходимый для того, чтобы реагирующие частицы могли вступить в хим. реакцию и определяется св-вами реаг-х ч-ц, их Е состоянием. Дифференциальное уравнение Аррениуса: дифференцируем логарифмическое по Т, откуда получаем, что чем больше Еа, тем быстрее увеличивается k с возрастанием Т.
Дата добавления: 2015-04-18; просмотров: 259; Мы поможем в написании вашей работы!; Нарушение авторских прав |