
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электролиз в процессах очистки воды
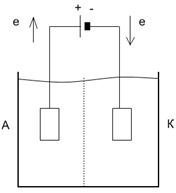
15. Приведите схему электролизера с электролитом - водным раствором какой - либо соли. Укажите анод, катод, направление движения электронов в проводниках первого рода и направление движения ионов в проводнике второго рода. Укажите материал электродов. Укажите состав продуктов в анодном и в катодном пространствах в случае электролиза водного раствора поваренной соли.
Ответы. При электролизе водного раствора поваренной соли
на аноде протекает электродная полуреакция окисления: 2CI-(в) – 2е = CI2(г)
на катоде протекает электродная полуреакция восстановления: Н2О(ж) + 2е = Н2(г) + 2ОН-(в)
16. Законы электролиза Фарадея.
Пусть на электроде протекает полуреакция
Х ± nе = Y (знак + для катода, знак – для анода)
1 - й закон Фарадея:
m(Y) = k(Y) · I · t
где m(Y) – масса вещества Y, выделившегося на электроде при протекании через него тока силой I А в течение времени t с
2 - й закон Фарадея:
k(Y) = М(Y)/nF
где k(Y) - электрохимический эквивалент вещества Y,
М(Y) – молекулярная масса вещества Y, кг/моль,
n – безразмерная величина, определяемая из уравнения электродной полуреакции,
F - постоянная Фарадея: F = е · NА = 96500 Кл/моль,
Справка: е = 1.602 · 10-19 Кл, 1 Кл = 1 А · 1 с, 1 Вт = 1 А · 1 В, 1 Вт = 1 Дж/1 с
17. Электрохимические методы очистки сточных вод: 1) анодное окисление и катодное восстановление анионов и катионов вредных веществ (приведите примеры), 3) электрокоагуляция, 4) электродиализ, 5) электрофлотация.
Примеры окисления и восстановления на аноде и на катоде:
анодное окисление: 2 СN- + 8 OH- - 10e = 2 CO2 + N2 + 4 H2O
катодное восстановление: Cr2O72- + 14 H+ + 12e = 2 Cr + 7 H2O.
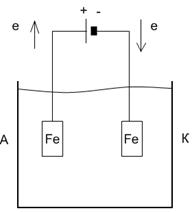
18. Очистка сточной воды с использованием метода электрокоагуляции основана на электрохимическом растворении материала железного анода с последующим образованием при участии растворенного в воде кислорода объемного студенистого осадка гидроксида железа(III). Нарисуйте схему электролизера. Составьте уравнения полуреакций, протекающих на аноде и на катоде, считая, что на катоде происходит восстановление воды. Какова роль растворенного в воде кислорода? От какого вида примесей очищается вода методом электрокоагуляции?
На аноде: Fe(т) – 2e = Fe2+(в)
На катоде: 2Н2О(ж) + 2е = Н2(г) + 2ОН-(в)
При смешивании анодного и катодного растворов образуется объемный студенистый осадок Fe(OH)2, который захватывает коллоидные и другие примеси, содержащиеся в воде. Осадок Fe(OH)2 затем доокисляется содержащимся в воде кислородом до еще менее растворимого Fe(OH)3. Осадок Fe(OH)3 с осажденными и адсорбированными на нем дисперсными и молекулярными примесями затем отделяют от воды в отстойнике.
19. Электродиализатор – это электролизер, межэлектродное пространство которого разделено на несколько камер с помощью попеременно расположенных катионо - и анионообменных пористых мембран. Поскольку катионообменные мембраны пропускают через поры только катионы, а анионообменные – только анионы, то камеры поочередно обедняются и обогащаются электролитами. В результате исходный раствор электролита делится на два потока – обессоленный и концентрированный. Электродиализ с использованием селективных мембран применяется для очистки сточных вод от ионных примесей.
Приведите схему электродиализатора, используемого для обессоливания воды. Почему катионообменная мембрана не пропускает анионы в направлении к аноду? Почему анионообменная мембрана не пропускает катионы в направлении к катоду? Приведите поясняющую схему ионообменной мембраны.

Схема электродиализатора. Пунктиром изображены последовательно слева направо анионо (А) и катионообменные (К) мембраны.
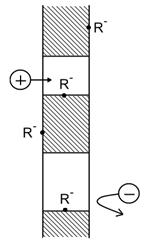
Схема катионообменной мембраны, на стенках которой расположены анионоактивные группы.
Составьте уравнения полуреакций, протекающих на аноде и на катоде электродиализатора в случае, когда исходная вода содержит только хлорид натрия.
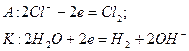
Очистка воды с применением обратного осмоса и ультрафильтрации
20. Осмосом называют процесс выравнивания концентраций в 2-х растворах, разделенных полупроницаемой перегородкой, пропускающей только молекулы растворителя. При осмосе молекулы растворителя диффундируют из раствора с меньшей концентрацией растворенного вещества, в раствор с большей концентрацией.
21. Осмотическое давление – избыточное давление в растворе, необходимое для того, чтобы остановить диффузию растворителя через полупроницаемую мембрану, отделяющую раствор от чистого растворителя. Оно обусловлено различием значений химического потенциала растворителя по обе стороны полупроницаемой мембраны.
Химический потенциал μi i – го компонента термодинамической системы в данной ее фазе определяется как частная производная  , где G – энергия Гиббса фазы.
, где G – энергия Гиббса фазы.
22. Обратный осмос (гиперфильтрация) – метод разделения растворов, заключающийся в том, что раствор под избыточным давлением 30 - 80 атм. подается на полупроницаемую мембрану, пропускающую растворитель (обычно воду), но задерживающую полностью молекулы и гидратированные ионы растворенных веществ, а так же частицы дисперсной фазы. Движущая сила процесса р > π. Если в фильтрате тоже содержится растворенное вещество (не 100% -ная очистка из-за несовершенства мембраны), то движущая сила процесса
р > (π1 - π2),
где р – давление исходного раствора, π1 и π2 - соответственно осмотические давления раствора и фильтрата. Нарисуйте схему установки.

Рис.22.1. Схема установки для обессоливания воды методом обратного осмоса.
23. Ультрафильтрация (микрофильтрация) – метод разделения коллоидных растворов, заключающийся в том, что раствор под избыточным давлением Δр = 1 - 5 атм. подается на полупроницаемую мембрану, пропускающую растворитель (обычно воду) и частицы истинных растворов, но задерживающую коллоидные и другие частицы дисперсной фазы.
24. Задача. Используя теоретическое выражение, полученное для идеальных растворов, оцените осмотическое давление p питьевой воды, в которой содержится только гидрокарбонат кальция. Общая жесткость воды Жобщ = сэ(Са2+) ∙103 = 7 (ммоль экв.Са2+)/л. Температура 20оС. Под каким избыточным давлением Dр (движущая сила процесса) можно обессолить питьевую воду с помощью полупроницаемых мембран? Изобразите схему установки. Это будет установка, в которой протекает процесс обратного осмоса, ультрафильтрации, обычной фильтрации? Как нужно изменять избыточное давление Dр вкамере с раствором, если уменьшается доля концентрата, выходящего из установки обессоливания?
Решение. Для вычисления суммарной концентрации присутствующих в воде ионов нужно сначала составить уравнение процесса растворения диссоциации сильного электролита гидрокарбоната кальция: 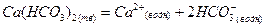
 ,
,
Жобщ = сэ(Са2+) (моль экв./л) ·103 (ммоль экв./моль экв.) = 7 ммоль экв./л,
сэ(Са2+) = 7 (ммоль экв./л) ·10-3 (моль экв./ммоль экв.) =
=7·10-3 (моль экв.)/л =7 моль экв./м3
см(Са2+) = 0,5 · сэ(Са2+) = 3.5 моль/м3,
см(НСО3-) = 2 · см(Са2+) = 7 моль/м3,
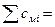 3.5 + 7 = 10.5 моль/м3,
3.5 + 7 = 10.5 моль/м3,
π = 10.5 (моль/м3) · 8.31 (Дж/моль · К) · 293 К =
= 2.66 · 104 Па = 0.26 атм. = 2640 мм вод. ст.
Избыточное давление при опреснении питьевой воды с помощью полупроницаемых мембран методом обратного осмоса должно составлять Dр > 0.26 атм.
Дополнение. В морской воде суммарная молярная концентрация ионов составляет 1.12 моль/л. Под каким избыточным давлением Dр можно обессоливать морскую воду с помощью обратного осмоса при 20оС?
π = 1.12·103 (моль/м3) · 8.31 (Дж/моль К) · 293 К = 2.73 · 106 Па = 27 атм.,
Dр > 27 атм.
Дата добавления: 2015-04-21; просмотров: 322; Мы поможем в написании вашей работы!; Нарушение авторских прав |