
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Структура аминокислот
 |
Общий вид формулы α-аминокислоты:
α-Углеродный атом связан с радикалом (R) аминокислоты, а также с α-амино- и α-карбоксильной группами.
В природе существует около 300 аминокислот, как свободных, так и полученных путем гидролиза белков и пептидов. В организме человека найдено 70 аминокислот, однако для синтеза новых белков в клетке животных, растений и микроорганизмов используются только 20 из них. Они получили название «протеиногенные аминокислоты». Структуры радикалов этих аминокислот представлены в табл. 1.
Таблица 1
Структура радикалов протеиногенных аминокислот
| Тип радикала | Название аминокислоты | Буквенное обозначение | Пептидный остов | Структура радикала |
| Неполярные (гидрофобные) радикалы аминокислот | Глицин Аланин Валин Лейцин Изолейцин Метионин Фенилаланин Триптофан Пролин | Гли, Gly, G Ала, Ala, A Вал, Val, V Лей, Leu, L Иле, Ile, I Мет, Met, M Фен, Phe, P Три, Trp, W Про, Pro, P | 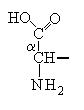
| –Н
–СН3






 (формула аминокислоты приведена полностью )
(формула аминокислоты приведена полностью )
|
| Полярные (гидрофильные) незаряженные радикалы аминокислот | Серин Треонин Цистеин Тирозин Аспарагин Глутамин | Сер, Ser, S Тре, Thr, T Цис, Cys, C Тир, Tyr, T Асн, Asn, N Глн, Gln, G | 
| 
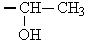



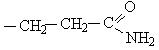
|
Окончание таблицы 1
| Тип радикала | Название аминокислоты | Буквенное обозначение | Пептидный остов | Структура радикала | |
| Полярные (гидрофильные) заряженные радикалы аминокислот | Отрицательно | Аспарагиновая кислота Глутаминовая кислота | Асп, Asp, D Глу, Gln, E | 
| 
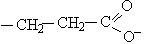
|
| Положительно | Лизин Аргинин Гистидин | Лиз, Lys, K Арг, Arg, R Гис, His, H | 


|
Остальные аминокислоты называют модифицированными, поскольку они образуются ферментативным путем из протеиногенных аминокислот после синтеза белка на рибосомах (например, оксипролин, оксилизин и др.)
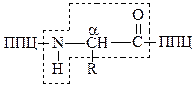 |
Последовательность аминокислот в цепи изображают начиная с N-концевой аминокислоты. С нее же начинается нумерация аминокислотных остатков. В полипептидной цепи (ппц) многократно повторяется группа:
 |
Эта группа формирует пептидный остов. Следовательно, полипептидная цепь состоит из остова (скелета), имеющего регулярную, повторяющуюся структуру, и отдельных боковых цепей радикалов аминокислот (R-групп):
Среди протеиногенных аминокислот есть такие, которые в организме человека и животных не синтезируются поступают только с пищей. Таких аминокислот десять и их называют «незаменимыми»:
 Ациклические аминокислоты Ациклические аминокислоты
| Валин Лейцин Изолейцин Треонин Метионин Аргинин Лизин | Циклические аминокислоты | Фенилаланин Триптофан Гистидин |
Аргинин и гистидин – это полузаменимые аминокислоты, так как могут синтезироваться в организме в ограниченном количестве.
Абсолютная незаменимость остальных восьми аминокислот, универсальна для всех видов организмов животного происхождения.
Остальные десять аминокислот – «заменимые» – могут синтезироваться в клетке из углеводов и глицерина или других аминокислот и метаболитов.
Дата добавления: 2015-02-09; просмотров: 306; Мы поможем в написании вашей работы!; Нарушение авторских прав |