
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Структуры глобулярного белка
Типы связей, участвующие в формировании третичной структуры белка (рис. 6).
1. Слабые связи:
– гидрофобная связь (ван-дер-ваальсова) – образуется между гидрофобными (неполярными) радикалами аминокислот;
– водородные связи – образуются между полярными незаряженными радикалами аминокислот;
– ионные или электростатические связи – образуются между полярными заряженными радикалами аминокислот.
2. Сильные связи (ковалентные):
– дисульфидная связь – образуется между двумя молекулами цистеина
– псевдопептидная (ложнопептидная) связь – образуется между карбоксильной группой радикала одной аминокислоты и аминогруппой радикала другой аминокислоты;
– сложно-эфирная связь – образуется между гидроксильной группой серина или треонина и карбоксильной группой радикалов глутаминовой и аспарагиновой кислот.
В последнее десятилетие ученые открыли, что в клетке имеются специализированные белки и белки-ферменты, которые регулируют процесс сворачивания новосинтезированных полипептидных цепей в правильную нативную третичную структуру. К ним относятся:
– фермент пептдил-пролил-цис/транс-изомераза – приводит к образованию цис-конформации пептидной связи, образованной атомом азота пролина, что вызывает поворот полипептидной цепи на 180о (на данном участке полипептидной цепи регулярность α-спирали нарушена);
– фермент протеиндисульфидизомераза – катализирует расщепление неправильно образованных дисульфидных связей и формирует новые S-S-связи, характерные для нативного белка.
– шапероны и шаперонины – это каталитически неактивные белки (открыл Л.Эллис) – «семейство белков», помогают правильной нековалентной сборке трехмерной белковой конформации и препятствуют формированию функционально неактивных белковых структур. Синтез шаперонов резко усиливается при стрессовом температурном воздействии, поэтому их называют «белки теплового шока». Шапероны удерживают новосинтезированную полипептидную цепь на рибосомах в развернутом состоянии, а шаперонины обеспечивают условия для образования единственно правильной третичной структуры белка.
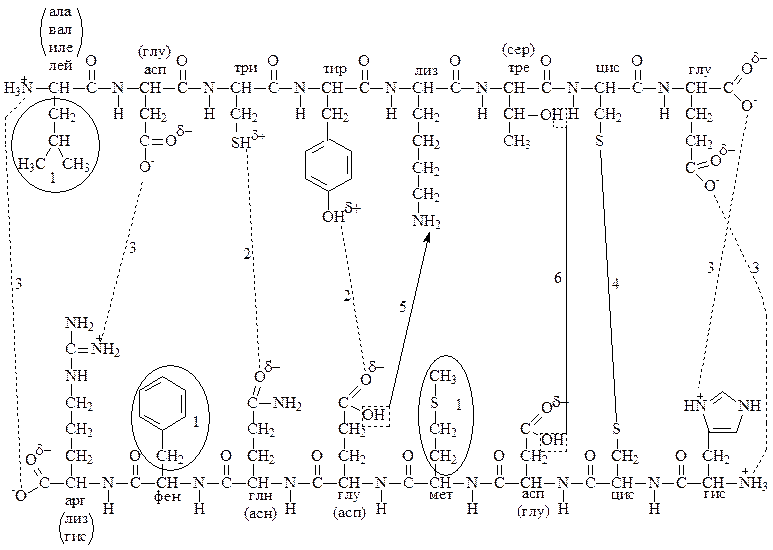
Рис. 6. Связи, участвующие в формировании третичной структуры белка
Дата добавления: 2015-02-09; просмотров: 357; Мы поможем в написании вашей работы!; Нарушение авторских прав |