
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водород. Элементы главной подгруппы VII группы
Тестовые задания по химии элементов периодической системы, естественно-математический факультет, специальность 5В011200 – Химия, рус. отд., группа 11
Преподаватели, ответственные за разработку тестов – Таурбаева Г.У.
Водород. Элементы главной подгруппы VII группы
1. При непосредственном взаимодействии простых веществ не протекает реакция:
A) H2+Cl2 ® ....
B) H2 + S ® ....
C) H2 + P ® ....
D) H2 + N2 ® ....
E) H2 + Ca ® ....
2. При непосредственном взаимодействии указанных простых веществ не протекает реакция:
A) H2+F2 ® ....
B) H2 + O2 ® ....
C) H2 + C ® ....
D) H2 + B ® ....
E) H2 + Na ® ....
3. При непосредственном взаимодействии простых веществ не протекает реакция:
A) Si + H2 ®
B) C + H2 ®
C) I2 + H2 ®
D) Li + H2 ®
E) N2 + H2 ®
4. К областям применения водорода относятся все, кроме:
A) Синтез аммиака, хлороводорода, метанола;
B) Восстановитель в металлургии;
C) Гидрогенизация жиров;
D) В смеси с СО применяется как топливо;
E) Синтез пероксида водорода.
5. Для получения водорода в промышленности применяются все реакции, кроме:
A) CH4 + H2O Û CO + 3H2;
B) CаH2 + 2H2O ® Ca(OH)2 + 2H2;
C) CO + H2O Û CO2 + H2;
D) 2CH4 + O2 ® 2CO + 4H2;
E) C + H2O ® CO + H2.
6. Для получения водорода в лаборатории не используется реакция:
A) 2CH4 + O2 + 2H2O ® 2CO2 + 6H2
B) Zn + 2HCl ® ZnCl2 + H2
C) 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
D) Mg + H2SO4 ® MgSO4 + H2
E) Электролиз водных растворов NaOH или KOH
7. «Гремучий газ» - это:
А) Смесь водорода и хлора
В) Смесь водорода и СО
С) Смесь кислорода и азота
D) Смесь кислорода и аммиака
Е) Смесь водорода и кислорода
8. К гидридам кислотного характера относится:
А) КН
В) СаН2
С) NaH
D) АlН3
Е) ВН3
9. Галогены как простые вещества непосредственно не реагируют с:
А) Водородом
В) Металлами
С) Фосфором
D) Кислородом
Е) Серой
10. Электролиз раствора NaCl не используется для получения:
A) Водорода;
B) Хлора;
C) Гидроксида натрия;
D) Натрия;
E) Жавелевой воды.
11. Кристаллы хлорида натрия имеют форму:
A) Шестигранных призм;
B) Октаэдров;
C) Куба;
D) Тетрагональную;
E) Гексагональную.
12. Смешанной соли соответствует формула:
A) Ca(OCl)2;
B) Ca(ClO4)2;
C) CaOCl2;
D) Ca(ClO3)2;
E) Ca(ClO2)2.
13. Из 3 моль хлората калия при его полном термическом разложении образуется кислорода (моль):
A) 6;
B) 9;
C) 3;
D) 4,5;
E) 2.
14. Галогены - это элементы:
А) Седьмой группы;
В) Главной подгруппы шестой группы;
С) Главной подгруппы седьмой группы;
D) Побочной подгруппы седьмой группы;
Е) Шестой группы
15. Неверное утверждение для характеристики галогенов:
А) Все галогены имеют одинаковую внешнюю электронную конфигурацию n s2 n p 5
В) Низшая степень окисления всех галогенов в соединениях равна –1
С) Все галогены обладают одинаковыми физическими свойствами
D) Фтор - наиболее электроотрицательный элемент
Е) Все галогены обладают очень резким запахом, токсичны.
16. Природный хлор состоит из смеси изотопов:
А) 35Cl, 36Cl;
B) 35Cl, 37Cl;
C) 37Cl, 38Cl;
D) 34Cl, 35Cl;
E) 35Cl, 38Cl.
17. Фтор в природе встречается в виде минерала:
А) Сильвин;
В) Плавиковый шпат;
С) Мрамор;
D) Карналлит;
Е) Пирит.
18. Формула минерала криолита:
A) Na3[AlF6];
B) CaF2;
C) 3Ca3(PO4)2 * CaF2 ;
D) NaCl;
E) KCl * MgCl2 * 6H2O.
19. Бром - это:
A) Бурый газ;
B) Красно-бурая жидкость;
C) Фиолетовые кристаллы;
D) Зеленовато-желтый газ;
E) Легкокипящая жидкость зеленоватого цвета.
20. Самые низкие температуры плавления и кипения имеет:
A) Иод;
B) Астат;
C) Фтор;
D) Хлор
E) Бром
21. Для извлечения иода из водных растворов пользуются растворимостью иода в:
A) Воде;
B) Кислом растворе;
C) Сероуглероде;
D) Щелочи;
E) Растворе иодида калия
22. Неверное утверждение:
A) Галогены встречаются в природе в свободном состоянии;
B) Фтор встречается в природе главным образом в виде плавикого шпата;
C) Главная масса хлорида натрия находится в воде морей и океанов;
D) Иод содержится в тканях некоторых водорослей;
E) Значительные количества брома содержатся в подземных буровых водах.
23. Свободные галогены проявляют чрезвычайно высокую:
A) Восстановительную активность;
B) Реакционную активность, которая ослабляется при переходе от иода к фтору;
C) Окислительную активность, которая уменьшается в подгруппе сверху вниз;
D) Каталитическую активность;
E) Термическую устойчивость.
24. Вследствие своей высокой электроотрицательности фтор может быть получен из соединений только:
A) Путем экстракции;
B) Электролизом растворов HF;
C) Электролизом растворов фторидов;
D) Электролизом расплавов фторидов;
E) Окислением фторид-ионов свободным хлором;
25. Фтороводородную (плавиковую) кислоту хранят:
А) В стальных баллонах
В) В сосудах из специальных сортов пластмасс
С) В алюминиевых цистернах
Д) В никелевых сосудах
Е) В резервуарах из листового железа
26. Фтор хранят и перевозят:
А) В стальных баллонах
В) В сосудах из специальных сортов пластмасс
С) В алюминиевых цистернах
Д) В никелевых сосудах
Е) В резервуарах из листового железа
27. При электролизе водного раствора хлорида натрия на инертных электродах выделяются:
A) Na, Cl2;
B) Na, O2;
C) H2, Cl2;
D) H2, O2;
E) Na, HCl.
28. Впервые хлор в свободном состоянии при нагревании пиролюзита с соляной кислотой получил:
A) Г. Дэви;
B) К. Бертолле;
C) К. Шееле;
D) Г. Кавендиш;
E) А. Лавуазье.
29. Концентрированная соляная кислота с выделением свободного хлора взаимодействует с:
A) Zn;
B) ZnO;
C) PbO;
D) MnO2;
E) NaOH.
30. Формула бертолетовой соли:
A) KCl;
B) KСlO;
C) KClO2;
D) KClO3;
E) KСlO4.
31. Для получения хлора из концентрированной соляной кислоты можно использовать:
A) MnO;
B) MnO2;
C) MgO;
D) PbO;
E) CaO.
32. Белящие свойства хлорной воды объясняются:
A) Присутствием хлора в воде;
B) Наличием соляной кислоты в растворе;
C) Наличием хлорноватистой кислоты в растворе;
D) Кислотными свойствами;
E) Наличием в растворе восстанавливающих веществ
33. Для получения хлороводорода в лаборатории используется пара веществ:
A) Раствор хлорида натрия и разбавленная серная кислота;
B) Раствор хлорида калия и азотная кислота;
C) Твердый хлорид натрия и концентрированная серная кислота;
D) Хлорная вода и серная кислота ;
E) Хлорная известь и уксусная кислота.
34. Формула белильной извести:
A) CaCl2;
B) Ca(OСl)2;
C) CaOCl2;
В) Ca(OH)2;
D) CaClO3.
35. Маслянистая жидкость, взрывающаяся при ударе, нагреве:
A) Cl2O;
B) Cl2O7;
C) ClO2;
D) Cl2O6;
E) ClO3.
36. В ряду HClO − HClO2 − HClO3 − HClO4 слева направо:
A) Сила кислот и их устойчивость повышается;
B) Сила кислот и их устойчивость понижается;
C) Сила кислот повышается, а устойчивость уменьшается;
D) Сила кислот уменьшается, а устойчивость повышается;
E) Окислительная активность повышается
37. Оксид хлора (VII) – это:
А) неустойчивая зеленовато - бурая маслянистая жидкость
В) бесцветная маслянистая жидкость, при нагревании разлагающийся со взрывом
С) легко разлагающееся при нагревании темно - красное кристаллическое вещество
Д) устойчивое кристаллическое вещество желтого цвета
Е) тугоплавкое вещество зеленого цвета
38. Соли хлорной кислоты по международной номенклатуре называются:
A) Хлориды;
B) Гипохлориты;
C) Перхлораты;
D) Хлораты;
E) Хлориты.
39. Формула бромноватой кислоты:
A) HBr;
B) HBrO2;
C) HBrO4;
D) HBrO3;
E) HBrO.
40. «Жавелевой водой» называют:
A) Раствор хлора в воде;
B) Раствор брома в воде;
C) Иодную воду;
D) Раствор хлора в щелочи;
E) Раствор брома в едком натре;
41. При пропускании хлора в горячий раствор гидроксида калия образуются продукты:
A) KCl, KClO3 и H2O;
B) KClO4 и H2O;
C) KCl и H2O;
D) KClO3 и H2O;
E) ClO2, KCl и H2O.
42. О фторе нельзя сказать, что он:
A) Самый активный;
B) Самый электроотрицательный;
C) Самый агрессивный;
D) Самый легкий элемент;
E) Самый сильный окислитель.
43. Наиболее ярко выражены окислительные свойства у:
A) Фтора;
B) Хлора;
C) Бромида;
D) Иода;
E) Серы.
44. Наиболее ярко выражены восстановительные свойства у:
A) фтора;
B) хлора;
C) бромида;
D) иодида;
E) хлорида.
45. Свободный хлор может выделиться в результате взаимодействия веществ:
A) HCl + Mg 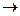 ......;
......;
B) HCl + MgO 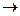 ......;
......;
C) HCl + Br2 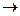 .....;
.....;
D) HCl + F2 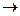 .....;
.....;
E) HCl + I2 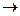 ..... .
..... .
46. Для отбеливания тканей, бумаги находит применение белильная известь, которая представляет собой продукт взаимодействия хлора с:
A) Н2О;
B) КОН;
C) Са(ОН)2;
D) Mg(OH) 2;
E) NaOH.
47. В результате взаимодействия бертолетовой соли с концентрированной соляной кислотой преимущественно образуется:
A) Н2;
B) С12;
C) НС1;
D) С12О;
E) О2.
48. Реакция хлора, позволяющая получить «жавелевую воду»:
А) Н2S + Cl2 + H2O →.
B) KI + Cl2 →.
C) H2O + Cl2 →.
D) NaOH (холодн.) + Cl2 →.
Е) Cr2(SO4)3 + KOH + Cl2 →.
49. Для осушения хлороводорода нельзя использовать:
A) Натронную известь;
B) Оксид фосфора (V);
C) Концентрированную серную кислоту;
D) Силикагель;
E) Хлорид кальция.
50. Признаки реакции распознавания хлорид-ионов в растворе:
A) Образование белого осадка, нерастворимого в кислотах, при приливании растворов солей бария;
B) “Вскипание” раствора вследствие выделения пузырьков газа при приливании растворов кислот;
C) Ощущение запаха нашатырного спирта при приливании раствора щелочи и нагревании;
D) Образование белого осадка, нерастворимого в кислотах, при приливании раствора нитрата серебра;
E) Выделение бурого газа при добавлении к раствору кусочка меди и концентрированной серной кислоты при нагревании.
51. Бесцветная жидкость с резким запахом, концентрированные растворы содержат около
37 % растворенного вещества, плотность 1,19 г/см3. Это – характеристика:
А) Серной кислоты
В) Азотной кислоты
С) Соляной кислоты
Д) Аммиака
Е) Пероксида водорода
Дата добавления: 2015-02-10; просмотров: 337; Мы поможем в написании вашей работы!; Нарушение авторских прав |