
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
С) 3 моль
D) 0,5 моль
Е) 4 моль
152. Продукты реакции КI+KNO2+H2SO4 → ... правильно показаны в ряду:
А) KNO3, I2, К2SO4, H2O
Б) KNO3, NO, К2SO4, H2O
С) I2, HNO3, К2SO4, H2O
Д) I2, NO, К2SO4, H2O
Е) KNO3, HI, К2SO4, H2O
153. Для свойств белого фосфора не характерно утверждение:
A) Уже при слабом нагревании воспламеняется и сгорает;
B) Может и самовоспламениться на воздухе;
C) Светится в темноте;
D) В воде нерастворим;
E) В сероуглероде не растворяется.
154. Молекулы Р4 имеет:
А) Красый фосфор
В) Белый фосфор
С) Черный фосфор
Д) Фиолетовый фосфор
Е) Желтый фосфор
155. Светится в темноте:
А) Красый фосфор
В) Белый фосфор
С) Черный фосфор
Д) Фиолетовый фосфор
Е) Желтый фосфор
156. Растворяется в сероуглероде:
А) Красый фосфор
В) Белый фосфор
С) Черный фосфор
Д) Фиолетовый фосфор
Е) Желтый фосфор
157. Молекулярную кристаллическую решетку имеет:
А) Красый фосфор
В) Белый фосфор
С) Черный фосфор
Д) Фиолетовый фосфор
Е) Желтый фосфор
158. Имеет атомно-слоистую решетку:
А) Красый фосфор
В) Белый фосфор
С) Черный фосфор
Д) Фиолетовый фосфор
Е) Желтый фосфор
159. Самовоспламеняется на воздухе:
А) Красый фосфор
В) Белый фосфор
С) Черный фосфор
Д) Фиолетовый фосфор
Е) Желтый фосфор
160.Хранят под водой:
А) Красый фосфор
В) Белый фосфор
С) Черный фосфор
Д) Фиолетовый фосфор
Е) Желтый фосфор
161. Не соответствует свойствам фосфина характеристика:
А) Бесцветный газ
В) Газ с неприятным запахом
С) Очень ядовитый
Д) Основные свойства выражены сильнее, чем чем у аммиака
Е) Горит на воздухе
162. При ожоге кожи белым фосфором средством первой помощи служит мокрая повязка,
пропитанная 5 %-ным раствором:
A) Na2SO4
B) K2SO4
C) AI2(SO4)3
Д) СuSO4
E) СaSO4
163. Ряд, в котором обе соли аммония разлагаются при нагревании необратимо:
A) NH4CI, (NH4)2 SO4;
B) NH4CI, (NH4)3PO4;
C) NH4CI, NH4NO3;
D) NH4NO3, NH4NO2;
E) (NH4)2 SO4, (NH4)3PO4.
164. Сурьма в природе встречается в виде:
А) Sb2O3
В) Sb2S3
С) SbН3
Д) SbСI3
Е) Sb2O5
165. Реакция, в результате которой получают простой суперфосфат:
А) Ca3(PO4)2 + 2H2SO4 → 2CaSO4 + Ca(H2PO4)2
В) Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
С) 2NH3 + H3PO4 → (NH4)2HPO4
Д) Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Е) (NH4)2HPO4 + NH4NO3 + KCI 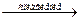
166. Реакция, в результате которой получают двойной суперфосфат:
А) Ca3(PO4)2 + 2H2SO4 → 2CaSO4 + Ca(H2PO4)2
В) Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
С) 2NH3 + H3PO4 → (NH4)2HPO4
Д) Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Е) (NH4)2HPO4 + NH4NO3 + KCI 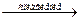
167. Реакция, в результате которой получают аммофос:
А) Ca3(PO4)2 + 2H2SO4 → 2CaSO4 + Ca(H2PO4)2
В) Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
С) 2NH3 + H3PO4 → (NH4)2HPO4
Д) Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Е) (NH4)2HPO4 + NH4NO3 + KCI 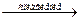
168. Удобрение нитрофоска получается в результате процесса:
А) Ca3(PO4)2 + 2H2SO4 → 2CaSO4 + Ca(H2PO4)2
В) Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
С) 2NH3 + H3PO4 → (NH4)2HPO4
Д) Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Е) (NH4)2HPO4 + NH4NO3 + KCI 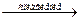
169. Качественной реакцией на NO является образование бурого комплекса при
взаимодействии его в растворе с:
A) СuSO4
B) FeSO4
C) CrCI3
Д) MnSO4
E) NiSO4
Дата добавления: 2015-02-10; просмотров: 242; Мы поможем в написании вашей работы!; Нарушение авторских прав |