
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Элементы главной подгруппы III группы
170.Одна из реакций аммиачно-хлоридного способа получения соды:
А) NH3 + CO2 + H2O ® NH4HCO3;
A) NH3 + HCl ® NH4Cl;
B) 2NaOH + CO2 ® Na2CO3 + H2O;
C) NH3 + H2O  NH4OH ;
NH4OH ;
Е) NaOH + CO2 ® NaHCO3.
171. К перечню реакций, используемых для получения соды в промышленности, не относится:
A) 2NH4Cl + Ca(OH)2 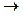 2NH3
2NH3  + CaCl2 + 2H2O;
+ CaCl2 + 2H2O;
B) NH3 + CO2 + H2O 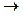 NH4HCO3;
NH4HCO3;
C) NH4HCO3 + NaCl 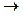 NaHCO3
NaHCO3  + NH4Cl;
+ NH4Cl;
D) 2NaOH + CO2 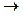 Na2CO3 + H2O;
Na2CO3 + H2O;
E) 2NaHCO3 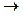 Na2CO3 + CO2
Na2CO3 + CO2  + H2O.
+ H2O.
172. Формулы, показывающие состав хрусталя и тугоплавкого стекла, одновременно находятся в ряду:
A) K2O·CaO·6SiO2; Na2O·CaO·6SiO2; K2O·PbO·6SiO2;
B) K2O·FeO·6SiO2; CaO· Na2O·6SiO2; CaO·FeO·6SiO2;
C) CaO·FeO·6SiO2; CaO·PbO·6SiO2; CaO·K2O·6SiO2;
D) FeO·PbO·6SiO2; PbO· K2O·6SiO2; Na2O·PbO·6SiO2;
E) CaO·PbO·6SiO2; K2O·CaO·6SiO2; Na2O·CaO·6SiO2.
173. Состав обычного оконного стекла:
A) K2O·CaO·6SiO2;
B) Na2O·CaO·6SiO2;
C) K2O·PbO·6SiO2;
D) K2O·FeO·6SiO2;
E) Na2O·PbO·6SiO2.
174. При нагревании не разлагается: 1
A) Na2CO3 ;
B) MgCO3 ;
C) CaCO3 ;
D) NaHCO3 ;
E) Ca(HCO3)2.
175. В качестве восстановителя в металлургии обычно не используется:
A) Уголь;
B) Медь;
C) Оксид углерода (II);
D) Кремний;
E) Алюминий.
176. Белое металлическое олово при длительном выдерживании на морозе переходит в серый порошок. Это связано с:
A) изменением аллотропной модификации олова;
B) взаимодействием с кислородом воздуха при низких температурах;
C) взаимодействием с водяными парами воздуха;
D) взаимодействием с углекислым газом воздуха;
E) взаимодействием с азотом воздуха.
177. В ряду С-Si-Ge-Sn-Pb неметаллические признаки элементов:
A) Возрастают;
B) Ослабевают;
C) Не изменяются;
D) Возрастают, а затем ослабевают;
E) Ослабевают, а затем возрастают.
178. Валентные орбитали атома углерода в молекуле метана СН4 можно описать на основе представлений о гибридизации типа:
A) sp;
B) sp2;
C) sp3;
D) d2sp3;
E) dsp2 .
179. Валентные орбитали атома кремния в молекуле силана SiH4 можно описать на основе представлений о гибридизации типа:
A) sp;
B) sp2;
C) sp3 ;
D) d2sp3;
E) dsp2.
180. Молекула силана имеет форму:
A) Линейную;
B) Плоскую;
C) Тетраэдричесую;
D) Октаэдрическую;
E) Квадратную.
181. При обработке карбоната металла кислотой образуется:
A) C (тв.)
B) О2 (г.)
C) СО (г.);
D) СО2 (г.);
E) Н2.
182. Масса (г) карбоната кальция, необходимая для получения 44,8 л углекислого газа, измеренного при н.у.:
A) 200,0;
B) 150,0;
C) 100,0;
D) 50,0;
E) 400,0.
183. Смещению равновесия реакции С(тв.) + СО2(г.)  2СО (г.) -119,8 кДж в правую сторону способствует фактор:
2СО (г.) -119,8 кДж в правую сторону способствует фактор:
А) Понижение температуры;
В) Понижение давления;
С) Повышение давления;
D) Добавление в систему газа СО;
Е) Удаление из системы газа СО2
184. В результате горения ацетилена в кислороде образуются:
A) Угарный газ и вода;
B) Углерод (сажа) и вода;
C) Углекислый газ и вода;
D) Углекислый газ и водород;
E) Углерод и водород.
185. Кремний энергично растворяется в растворах щелочей. При этом роль окислителя выполняют:
A) Ионы Na+;
B) Вода;
C) Кремний;
D) Ионы ОН-;
E) NaOH .
186. Ортокремниевая кислота образует коллоидный раствор или золь. Это связано с тем, что она
A) Взаимодействует с молекулами воды с образованием гидратов;
B) В водном растворе вступает в реакцию поликонденсации;
C) Как слабая кислота в растворе образует мало ионов;
D) Реагируя с кислородом воздуха, окисляется;
E) Разлагается на диоксид кремния и воду.
187. Правильная для структуры угля характеристика:
A) Кристаллизуется в кубической гранецентрированной решетке, атомы углерода находятся в состоянии sp3-гибридизации;
B) Слоистое кристаллическое вещество с гексагональной решеткой, атомы углерода находятся в состоянии sp2- гибридизации;
C) Состоит из мельчайших кристалликов с разупорядоченной структурой графита;
D) Его гексагональная решетка построена из прямолинейных цепочек С∞, в которых атомы углерода находятся в состоянии sp – гибридизации;
E) Кристаллизуется в кубической объемноцентрированной решетке.
188. Характеристика структуры алмаза:
A) Кристаллизуется в кубической гранецентрированной решетке, атомы углерода находятся в состоянии sp3-гибридизации;
B) Слоистое кристаллическое вещество с гексагональной решеткой, атомы углерода находятся в состоянии sp2- гибридизации;
C) Состоит из мельчайших кристалликов с разупорядоченной структурой графита;
D) Его гексагональная решетка построена из прямолинейных цепочек С∞, в которых атомы углерода находятся в состоянии sp – гибридизации;
E) Кристаллизуется в кубической объемноцентрированной решетке.
189. Характеристика структуры графита:
A) Кристаллизуется в кубической гранецентрированной решетке, атомы углерода находятся в состоянии sp3-гибридизации;
B) Слоистое кристаллическое вещество с гексагональной решеткой, атомы углерода находятся в состоянии sp2- гибридизации;
C) Состоит из мельчайших кристалликов с разупорядоченной структурой графита;
D) Его гексагональная решетка построена из прямолинейных цепочек С∞, в которых атомы углерода находятся в состоянии sp – гибридизации;
E) Кристаллизуется в кубической объемноцентрированной решетке.
190. Признаки реакции распознавания карбонатов:
A) Образование белого осадка, нерастворимого в кислотах, при приливании растворов солей бария;
B) “Вскипание” раствора вследствие выделения пузырьков газа при приливании растворов кислот;
C) Ощущение запаха нашатырного спирта при приливании раствора щелочи и нагревании;
D) Образование белого осадка, нерастворимого в кислотах, при приливании раствора нитрата серебра;
E) Выделение бурого газа при добавлении к раствору кусочка меди и концентрированной серной кислоты при нагревании.
191. При невысоких температурах уголь сгорает до СО2, а оксид углерода (II) почти не образуется, потому что:
A) Стандартная энергия Гиббса образования СО2 более отрицательна (-394 кДж/моль), чем ∆Gобр для СО (-137 кДж/моль);
B) Не создаются условия, при которых в реакции будет недостаток кислорода;
C) Оксид углерода (II) образуется, но он тотчас же окисляется до СО2;
D) Стандартная энергия Гиббса образования СО более отрицательна, чем ∆Gобр для СО2;
E) Оксид углерода (II) – несолеобразующий оксид.
192. Между атомами образуется тройная связь в молекуле:
A) Cl2;
B) CO;
C) CO2;
D) HF;
E) NaCl.
193. Ядовитое действие оксида углерода (II) объясняется тем, что:
A) Раздражает слизистую оболочку дыхательных путей;
B) Легко соединяется с гемоглобином крови и делает его неспособным переносить кислород от легких к тканям; 2bm
C) Ингибирует функцию различных ферментов в организме;
D) Легко соединяется с кислородом воздуха, вследствие чего кислород с воздухом не поступает в ткани;
E) Оксид (II) углерода вместе с кислородом поступает в ткани и участвует в обмене веществ.
194. Масса известняка (кг), необходимая для получения 112 кг негашеной извести: 1bm
A) 200;
B) 50;
C) 100;
D) 30;
E) 20.
195. Кристаллы кварца, называемые горным хрусталем, имеют форму:
A) Шестигранных призм;
B) Октаэдров;
C) Куба;
D) Тетрагональную;
E) Гексагональную.
196. Соль угольной кислоты, используемая в качестве удобрения:
A) NaHCO3;
B) Na2CO3;
C) K2CO3;
D) CaCO3;
E) MgCO3.
197. Порода, содержащая известняк и глину в соотношениях, аналогичных цементу:
A) Мергель
B) Бетон
C) Клинкер
D) Шлак
E) Калонит
198. Вытравливание на стекле надписей и рисунков основано на реакции:
A) SiO2 + 4HF ® SiF4 + 2H2O;
B) SiO2 + 2NaOH ® Na2SiO3 + H2O;
C) Na2SiO3 + 2HCl ® 2NaCl + H2SiO3;
D) SiO2 + CaCO3 ® CaSiO3 + CO2;
E) SiO2 + 2F2 ® SiF4 + O2.
199. Не имеет отношения к диоксиду кремния:
A) Кремнезем;
B) Кварц;
C) Песок;
D) Рубин;
E) Горный хрусталь.
200. При изготовлении тугоплавкого стекла для химической посуды:
A) Сплавляют смесь белого песка, соды и известняка;
B) Сплавляют смесь белого песка, поташа и известняка;
C) Сплавляют смесь белого песка, поташа и оксида свинца;
D) К смеси компонентов для получения обычного стекла добавляют соединения кобальта;
E) К смеси компонентов для получения обычного стекла добавляют Cr2O3.
201. При изготовлении хрустального стекла:
A) Сплавляют смесь белого песка, соды и известняка;
B) Сплавляют смесь белого песка, поташа и известняка;
C) Сплавляют смесь белого песка, поташа и оксида свинца;
D) К смеси компонентов для получения обычного стекла добавляют соединения кобальта;
E) К смеси компонентов для получения обычного стекла добавляют Cr2O3.
202. При изготовлении обычного оконного стекла:
A) Сплавляют смесь белого песка, соды и известняка;
B) Сплавляют смесь белого песка, поташа и известняка;
C) Сплавляют смесь белого песка, поташа и оксида свинца;
D) К смеси компонентов для получения обычного стекла добавляют соединения кобальта;
E) К смеси компонентов для получения обычного стекла добавляют Cr2O3.
203. При изготовлении стекла синего цвета:
A) Сплавляют смесь белого песка, соды и известняка;
B) Сплавляют смесь белого песка, поташа и известняка;
C) Сплавляют смесь белого песка, поташа и оксида свинца;
D) К смеси компонентов для получения обычного стекла добавляют соединения кобальта;
E) К смеси компонентов для получения обычного стекла добавляют Cr2O3.
204. При растворении олова в концентрированной азотной кислоте образуется:
А) Нитрат олова (II);
В)  -Оловянная кислота;
-Оловянная кислота;
С)  - Оловянная кислота;
- Оловянная кислота;
D) Оловянистая кислота;
Е) Гидроксид олова (II);
205. При действии раствора аммиака на раствор хлорида олова (IV) образуется:
А) Нитрат олова (II);
В)  -Оловянная кислота;
-Оловянная кислота;
С)  - Оловянная кислота;
- Оловянная кислота;
D) Оловянистая кислота;
Е) Гидроксид олова (II);
206. При растворении олова в концентрированной серной кислоте образуется:
А) Сульфат олова (II);
В) Сульфат олова (III);
С) Диоксид олова;
D) Сульфат олова (IV);
Е) Гидроксид олова (II);
207. Не соответствует свойствам  -оловянной кислоты:
-оловянной кислоты:
А) Выпадает в виде белого осадка при соответствующей реакции;
В) При высушивании постепенно теряет воду;
С) При высушивании превращается в диоксид олова;
D) Растворяется в щелочах и кислотах;
Е) Растворяется в воде.
208. Не соответствует свойствам  -оловянной кислоты:
-оловянной кислоты:
А) Белый порошок;
В) Не растворяется в кислотах;
С) Растворяется в кислотах;
D) Не растворяется в растворах щелочей;
Е) При сплавлении со щелочами переходит в раствор в виде станната.
209. Германий окисляется концентрированной серной кислотой до:
А) Германиевой кислоты;
В) Оксида германия (II);
С) Диоксида германия;
D) Сульфата германия (II);
Е) Сульфата германия (IV);
210. Типографским сплавом или гартом называют:
А) Сплав висмута со свинцом, оловом и кадмием (сплав Вуда)
В) Сплав алюминия с кремнием
С) Сплав алюминия с магнием
Д) Сплав свинца с сурьмой и оловом
Е) Сплав олова с сурьмой и медью
211. Для изготовления подшипников используется:
А) Сплав висмута со свинцом, оловом и кадмием (сплав Вуда)
В) Сплав алюминия с кремнием
С) Сплав алюминия с магнием
Д) Сплав свинца с сурьмой и оловом
Е) Сплав олова с сурьмой и медью
212. Сплавы только на основе алюминия содержит ряд:
А) Электрон, силумин
В) Силумин, магналий
С) Электрон, магналий
Д) Мельхиор, манганин
Е) Электрон, мельхиор
213. Плотность алюминия (г/см3 ):
А) 0,534
В) 2,7
С) 2,07
Д) 7,87
Е) 22,5
214. Не имеет отношения к оксиду алюминия:
A) Рубин;
B) Сапфир;
C) Глинозем;
D) Карборунд;
E) Корунд.
215. По составу является оксидом алюминия:
A) Аметист;
B) Дымчатый топаз;
C) Сапфир;
D) Яшма;
E) Агат.
216. Не может быть:
A) Сульфата гидроксоалюминия;
B) Сульфата дигидроксоалюминия;
C) Гидросульфата алюминия;
D) Дигидросульфата алюминия;
E) Дигидрофосфата алюминия.
217. При сливании растворов AlCl3 и Na2CO3 образуются:
A) Al(OH)3; CO2; NaCl;
B) Al2(CO3)3; NaCl;
C) AlOHCO3; NaCl;
D) Al(HCO3)3; NaCl;
E) (Al(OH)2)2CO3; NaCl.
218. При получении алюминия в промышленности электролизу подвергают расплавленную смесь криолита Na3[AlF6] и оксида алюминия. Это связано с тем, что:
A) Необходимо получить фтор на аноде;
B) Необходимо получить натрий на катоде;
C) Данная смесь обладает более низкой температурой плавления и хорошей электропроводностью по сравнению с оксидом алюминия;
D) Необходимо получить гидроксид натрия в расплаве по окончании электролиза;
E) В сравнении с криолитом оксид алюминия обладает более низкой температурой плавления и высокой электропроводностью
219. В природе встречается соединение бора:
A) B2O3;
B) H3BO3;
C) Mg3B2;
D) B4H10;
E) BF3.
220. Летучая жидкость с неприятным запахом, пары которой воспламеняются на воздухе:
A) B2O3;
B) H3BO3;
C) Mg3B2;
D) B4H10;
E) BF3.
221. Образование перла буры показано уравнением реакции:
A) Na2B4O7 + H2SO4 + 5H2O ® Na2SO4+ 4H3BO3;
B) 4H3BO3 + 2NaOH + 3H2O ® Na2B4O7*10H2O;
C) Na2B4O7 + CoO ® 2NaBO2*Co(BO2)2;
D) Na2B4O7*10H2O 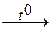 Na2B4O7 + 10H2O;
Na2B4O7 + 10H2O;
E) B2O3 + 3H2O ® 2H3BO3.
222. Перлы буры образуются:
A) При прокаливании буры с солями или другими соединениями некоторых металлов;
B) При потере бурой кристаллизационной воды при нагревании;
C) При нейтрализации борной кислоты избытком щелочи;
D) При нагревании борной кислоты;
E) При сплавлении борного ангидрида с оксидами металлов.
223. В природе в виде минерала сассолин встречается:
A) Na2B4O7*10H2O;
B) Na2B4O7*4H2O;
C) H3BO3;
D) K[BF4];
E) B2O3.
224. К областям применения буры относятся все, кроме:
A) Сварка, паяние металлов;
B) Производство легкоплавкой глазури для фарфоровых изделий;
C) Изготовление специальных сортов стекла;
D) Изготовление обычного сорта стекла;
E) Производство микроудобрений.
225. Валентные орбитали атома бора в молекуле BF3 гибридизованы по типу:
A) sp;
B) sp2;
C) sp3;
D) d2sp3 ;
E) d2sp.
226. В промышленности для получения алюминия осуществляется реакция:
A) Al2O3 + 2Cr ® Cr2O3 + 2Al;
B) 2Al2O3  4Al + 3O2;
4Al + 3O2;
C) AlCl3 + 3K ® Al + 3KCl;
D) Al2O3 + 3H2 ® 2Al + 3H2O;
E) Al2(SO4)3 + 6Na ® 3Na2SO4 + 2Al.
227. При гидролизе AI 2(SO4)3 по второй ступени образуются:
А) AIOH SO4 +H2SO4
В) [AI(OH)2]2 SO4 +H2SO4
С) AI(OH)3 + H2SO4
Д) AI(H SO4)3 +H2SO4
Е) AI2O3 +H2SO4
228. При сливании каких растворов друг с другом гидроксид алюминия не образуется:
А) AlCI3 + Na2CO3 →
B) AlCI3 + Na2S →
C) AlCI3 + Na2SO3 →
Д) AlCI3 + Na2SeO3 →
E) AlCI3 + Na2SO4 →
229. К раствору хлорида алюминия, чтобы образовался осадок Al(OH)3, нужно прилить раствор:
А) Na2CO3
В) Na2SO4
С) NaNO3
Д) NaCIO4
Е) Na2SeO4
230. К раствору хлорида алюминия, чтобы образовался осадок Al(OH)3, нужно прилить раствор:
А) Na2S
В) Na2SO4
С) NaNO3
Д) NaCIO4
Е) Na2SeO4
231. К раствору хлорида алюминия, чтобы образовался осадок Al(OH)3, нужно прилить раствор:
А) Na2SO3
В) Na2SO4
С) NaNO3
Д) NaCIO4
Е) Na2SeO4
Дата добавления: 2015-02-10; просмотров: 374; Мы поможем в написании вашей работы!; Нарушение авторских прав |