
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Классификация неорганических соединений
Большинство неорганических соединений могут быть разделены на три основных класса (типа): оксиды, гидроксиды и соли. Для лучшего понимания бескислородные кислоты можно условно выделить в отдельний класс неорганических соединений. Общая схема классификации представлена на рис 1 (см. приложение 1). Эта классификация не является полной, так как в нее не вошли некоторые менее часто встречающиеся бинарные (то есть состоящие из двух элементов) соединения (например, арсин – AsH3, сероуглерод –CS2 и пр.).
Оксиды
Химические соединения элементов с кислородом вида 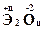 называются оксидами (степень окисления атома О в оксидах равна «-2»).
называются оксидами (степень окисления атома О в оксидах равна «-2»).
Систематическая номенклатура оксидов: на первом месте указывают название элемента в именительном падеже с соответствующими греческими количественными приставками, далее - слово «оксид» также с соответствующими количественными приставками, например: SiO2- кремний диоксид, Fe2O3- дижелезо триоксид , P2O5- дифосфор пентоксид и т.д..
Полусистематическая (международная) номенклатура: на первом месте находится слово «оксид», за которым следует название элемента в родительном падеже с указанием римскими цифрами в скобках его степени окисления, например:
Fe2O3 – оксид железа (III), допускается запись: оксид Fe (III);
FeO- оксид железа (II), допускается запись: оксид Fe(II);
P2O3- оксид фосфора (III);
P2O5- оксид фосфора (V);
NO – оксид азота (II), допускается запись монооксид азота;
NO2 – оксид азота (IV), допускается запись диоксид азота.
Na2O – оксид натрия ( натрий имеет только одно значение степени окисления в соединениях, в таких случаях ее не указывают).
Русская номенклатура в названиях оксидов оперирует словом «окись» с указанием количества атомов кислорода на один атом элемента, например: N2O – полуокись азота,
Fe2O3 – полутороокись железа,
CO2 – двуокись углерода.
Следует отметить, что в русской номенклатуре оксид элемента с низшей степенью окисления часто называли закисью элемента, а оксид того же элемента с высшей степенью окисления – окисью, например: Сu2О - закись меди, CuO- окись меди.
Существуют соединения элементов с кислородом, которые не проявляют свойств оксидов (в этих соединениях атом кислорода имеет степень окисления, которая не равна «-2»). Например, Н2О2-1- пероксид водорода (перекись водорода), проявляет свойства слабой кислоты, Na2O2-1 - пероксид натрия – соль. В этих соединениях содержится группы атомов –О–О– или анион 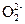 . Схема классификации оксидов приведена на рис. 2 (см. приложение 2).
. Схема классификации оксидов приведена на рис. 2 (см. приложение 2).
Дата добавления: 2015-02-10; просмотров: 270; Мы поможем в написании вашей работы!; Нарушение авторских прав |