
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислородсодержащие кислоты
Кислородсодержашие кислоты также относятся к гидроксидам. Это электролиты, образующие при диссоциации в водных растворах из положительно заряженных ионов только ионы водорода H+, или, более точно, ионы гидроксония Н3О+- гидратированный ион водорода. Более общее определение: кислоты – это вещества, являющиеся донорами протонов Н+. В зависимости от количества катионов водорода, образующихся при диссоциации кислоты, кислоты классифицируют также как основания, по основности. Существуют одно-, двух-, трех- и четырехосновные кислоты. Например, азотная кислота HNO3, азотистая кислота HNO2 –одноосновные кислоты, угольная кислота H2CO3, серная кислота H2SO4 – двухосновные кислоты, ортофосфорная кислота H3PO4 является трехосновной кислотой, а ортокремниевая кислота H4SiO4 –четырехосновной кислотой.
Номенклатура кислородсодержащих кислот: по международной систематической номенклатуре названия кислородсодержащих кислот формируются, как указывалось ранее, с учетом аниона, входящего в состав кислоты. Например:
H3PO4 - триводород тетраоксофосфат(V) или триводород ортофосфат
H2CO3 - диводород триоксокарбонат (IV)
HNO3 - водород триоксонитрат (V)
Н2SiO3 - диводород триоксосиликат (IV) или диводород метасиликат
H2SO4- диводород тетраоксосульфат(VI) (количество атомов водорода в кислотах можно не указывать)
По систематической номенклатуре названия кислот используют редко, чаще всего применяют традиционно сложившиеся названия, которые формируются от русского названия элемента (русская номенклатура) по определенным правилам (см. таблицу). В таблице приведен перечень кислородсодержащих кислот, соли которых наиболее распространены в природе. Следует обратить внимание, что название кислотного остатка определяет название соли и строят его чаще всего по полусистематической (международной) номенклатуре от латинского названия элемента. В связи с этим необходимо вспомнить латинские названия элементов наиболее часто встречающихся в кислотах, например, N – азот, в русской транскрипции латинского названия звучит как [нитрогениум], С – углерод – [карбониум], S – сера – [сульфур], Si- кремний – [силициум], олово – [станнум], свинец – [плюмбум], мышьяк – [арсеникум] и т.д. В таблице приведены общие правила, в соответствии с которыми можно назвать большинство неорганических кислородсодержащих кислот других элементов, их кислотные остатки и соли.
Таблица наиболее распространенных кислородсодержащих кислот
| Формула кислоты | Название кислоты по русской номенклатуре | Кислотный остаток | Название кислотного остатка и соли |
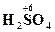
| серная | SO42- HSO4- | сульфат-ион, сульфаты, гидросульфат-ион, гидросульфаты |
| +4 H2SO3 | cернистая | SO32- HSO4- | cульфит-ион, сульфиты, гидросульфит-ион, гидросульфиты |
| +5 HNO3 | азотная | NO3- | нитрат-ион; нитраты |
| +3 HNO2 | азотистая | NO2- | нитрит-ион, нитриты |
| +5 HPO3 | метафосфорная | PO3- | метафосфат-ион, метафосфаты |
| +5 H3PO4 | ортофосфорная | PO43- H2PO4- HPO42 | ортофосфат-ион, ортофосфаты, дигидро(орто)фосфат-ион, дигидро(орто)фосфаты, гидро(орто)фосфат-ион, гидро(орто)фосфаты |
| +5 H4P2O7 | двуфосфорная (пирофосфорная) | P2O74- | пирофосфат-ион, пирофосфаты |
| +3 HPO2 | фосфористая | PO2- | фосфит-ион, фосфиты |
| H2CO3 | угольная | CO32- HCO3- | карбонат-ион, карбонаты, гидрокарбонат-ион, гидрокарбонаты |
| H2SiO3 | метакремниевая | SiO32- HSiO3- | метасиликат-ион, метасиликаты, гидрометасиликат-ион, гидрометасикаты |
| H4SiO4 | ортокремниевая | SiO44- H3SiO4- H2SiO42- HSiO43- | ортосиликат-ион; ортосиликаты, тригидро(орто)силикат-ион, тригидро(орто)силикаты, дигидро(орто)силикат-ион дигидро(орто)силикаты, гидроортосиликат-ион, гидроортосиликаты |
| H2CrO4 | хромовая | CrO4- | хромат-ион, хроматы |
| H2Cr2O7 | двухромовая | Cr2O72- | бихромат-ион, бихроматы |
| HClО | хлорноватистая | ClO- | гипохлорит-ион, гипохлориты |
| HClO2 | хлористая | ClO2- | хлорит-ион, хлориты |
| HClO3 | хлорноватая | ClO3- | хлорат-ион, хлораты |
| HClO4 | хлорная | ClO4- | перхлорат-ион, перхлораты |
Гидросоли и названия их кислотных остатков будут рассмотрены в разделе«соли». Правила названия кислородсодержащих кислот и кислотных остатков (за исключением тех, которые имеют тривиальные названия или их следует называть по систематической номенклатуре) следующие:
 высшая с. о. элемента (равна № группы в периодической системе) – корень русского названия элемента + окончание «ая» или «овая»
высшая с. о. элемента (равна № группы в периодической системе) – корень русского названия элемента + окончание «ая» или «овая»
Название
с. о. – степень окисления
кислородсодержащей
кислоты
 с.о. элемента < max – корень русского названия элемента +
с.о. элемента < max – корень русского названия элемента +
окончание «истая» или «овистая»
 высшая с.о. элемента – корень латинского названия элемента +
высшая с.о. элемента – корень латинского названия элемента +
Название суффикс «ат»
кислотного
 остатка
остатка
с.о. элемента < max – латинское название элемента + суффикс «ит»
Зная приведенные правила, легко вывести формулы кислот для различных элементов ( с учетом положения в периодической системе ) и назвать их. Например, металл Sn - олово ( 1V гр.) латинское название - stannum ( «станнум»):
Max с.о. = +4 Min с.о. = +2
Оксиды: SnO2 SnO
амфот. амфот.
+Н2О+Н2О
Н2SnO3 H2SnO2
оловянная кислота оловянистая кислота
SnO32- SnO22-
станнат- ион, станнит-ион,
Na2SnO3 – станнат Na Na2SnO2 – станнит Na
Оксидам некоторых элементов соответствуют две кислоты: мета- и ортокислота, формально они отличаются на одну молекулу Н2О.
Вывод формулы мета и ортокислоты ( если они существуют у данного элемента): при формальном присоединении к оксиду одной молекулы Н2О получаем формулу метакислоты, последующее присоединение еще одной молекулы воды к формуле метакислоты позволяет вывести формулу ортокислоты. Например, выведем формулу мета- и ортокислоты, соответствующей оксиду P (V):
P2O5 HPO3
+H2O +H2O
H2P2O6 à HPO3 - метафосфорная к-та H3PO4 - ортофосфорная к-та
Приведем пример обратной задачи: назвать соли NaBO2 и K3BO3. Степень окисления атома бора в этих солях равна +3 ( проверьте расчет), следовательно, соли образованы от кислотного оксида В2О3. Если в обеих солях степени окисления бора одинаковые, а виды кислотных остатков разные, то это соли мета- и ортоборной кислоты. Выведем формулы этих кислот:
В2О3 НВО2
+ Н2О + Н2О
НВО2 - метаборная кислота, Н3ВО3 - ортоборная кислота,
соли – метабораты соли – ортобораты
Названия солей: NaBO2 – метаборат натрия; Na3 BO3 - ортоборат натрия.
Дата добавления: 2015-02-10; просмотров: 1225; Мы поможем в написании вашей работы!; Нарушение авторских прав |