
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ОСНОВЫ ТЕРМОХИМИИ
Термохимия - область науки, изучающая тепловые эффекты, которыми сопровождаются химические реакции. Тепловым эффектом химической реакции Q называют количество теплоты, которое поглощается или выделяется при полном необратимом протекании реакции в изобарно-изотермических или изохорно-изотермических условиях.
Если в результате реакции теплота выделяется во внешнюю среду, то Q считается положительным, а реакцию называют экзотермической. При протекании процесса с поглощением теплоты реакцию называют эндотермической, а Q считается отрицательным. Согласно принятой системе знаков, между Q и q должно выполняться следующее соотношение
Q = -q .
Тепловой эффект реакции, определенный в изобарно-изотермических условиях обозначается QP , а в изохорно-изотермических QV . Из первого закона термодинамики следует, что тепловой эффект реакции является функцией состояния системы, то есть не зависит от способа осуществления реакции. Математически это отражается уравнениями
QV = -qV = -DU ; QP = -qp = -DH .
Основным законом термохимии является закон Гесса: тепловой эффект химической реакции не зависит от пути ее протекания, то есть числа и характера промежуточных стадий, а зависит только от природы и состояния исходных веществ и продуктов реакции. Исторически закон Гесса был сформулирован раньше первого закона термодинамики.
Поясним закон Гесса на примере образования диоксида углерода. СО2 может быть получен двумя способами
I способ: С + О2 = СО2 + Q1 ;
II способ: 1) С + 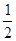 О2 = СО + Q2 ; 2) СО +
О2 = СО + Q2 ; 2) СО + 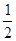 О2 = СО2 + Q3 .
О2 = СО2 + Q3 .
Согласно закону Гесса, тепловые эффекты образования СО2 по I и II способу должны быть равны, то есть Q1 = Q2 + Q3 .
Уравнение химической реакции, записанное с указанием его теплового эффекта, называется термохимическим уравнением. Такие уравнения имеют ряд особенностей:
1) указывается фазовое состояние или полиморфная модификация веществ, кроме очевидных случаев (г - газовое, ж - жидкое, к - кристаллическое, т - твердое, р - растворенное и др.);
2) допускаются дробные коэффициенты перед веществами;
3) имеется возможность производить с уравнениями некоторые алгебраические операции (сложение, вычитание, деление или умножение на целое число).
В термохимических уравнениях тепловой эффект принято записывать либо непосредственно в уравнении реакции, например:
Н2, г + 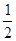 О2, г = Н2Ож + QP кДж
О2, г = Н2Ож + QP кДж
либо после уравнения Н2, г + 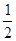 О2, г = Н2Ож , DН = -QP
О2, г = Н2Ож , DН = -QP 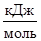 .
.
Последняя форма записи употребляется чаще, поэтому в дальнейшем будет использоваться только такая форма записи.
Для удобства тепловые эффекты различных процессов определяют при одинаковых условиях: давлении 101325 Па и температуре 298 К. Такие условия называются стандартными, а соответствующим им тепловой эффект - стандартным тепловым эффектом. Стандартные тепловые эффекты обозначают DH  (DU
(DU  ).
).
Из закона Гесса вытекает несколько важных следствий. Рассмотрим некоторые из них.
Следствие 1: теплота, выделяющаяся при образовании вещества, равна теплоте, поглощаемой при разложении такого же его количества на исходные составные части (иначе это закон Лавуазье-Лапласа). Это означает, что, например, для реакций
СаСО3, т = СаОт + СО2, г , DН1;
СаОт + СО2, г = СаСО3, т , DН2
при одинаковых температурах будет выполняться соотношение DН1 = -DН2 .
Следствие 2: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Для реакции общего вида aA + bB = dD + fF данное следствие означает
DН = dDН 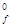 (D) + fDН
(D) + fDН 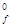 (F) - aDН
(F) - aDН 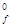 (A) - bDН
(A) - bDН 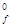 (B).
(B).
Энтальпией образования вещества DН 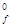 называют изменение энтальпии реакции образования 1 моль данного вещества из простых веществ. Если энтальпия образования вещества определена при стандартных условиях, то ее называют стандартная энтальпия образования вещества и обозначают DН
называют изменение энтальпии реакции образования 1 моль данного вещества из простых веществ. Если энтальпия образования вещества определена при стандартных условиях, то ее называют стандартная энтальпия образования вещества и обозначают DН  . Для большинства веществ DН
. Для большинства веществ DН  определены и приводятся в справочной литературе (значения некоторых из них см. в приложении). Стандартные энтальпии образования простых веществ, устойчивых при стандартных условиях, приняты равными нулю. Например, устойчивой модификацией углерода при стандартных условиях является графит, а неустойчивой - алмаз, поэтому DН
определены и приводятся в справочной литературе (значения некоторых из них см. в приложении). Стандартные энтальпии образования простых веществ, устойчивых при стандартных условиях, приняты равными нулю. Например, устойчивой модификацией углерода при стандартных условиях является графит, а неустойчивой - алмаз, поэтому DН  (Сграфит) = 0, а DН
(Сграфит) = 0, а DН  (Салмаз) = 1,9
(Салмаз) = 1,9 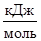 .
.
Следствие 3: энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ минус сумма энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Или математически для реакции вида aA + bB = dD + fF
DН = aDН  (A) + bDН
(A) + bDН  (B) - dDН
(B) - dDН  (D) - fDН
(D) - fDН  (F).
(F).
Энтальпией сгорания вещества DН  называют изменение энтальпии реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов. Значения энтальпий сгорания веществ имеются в справочной литературе. DН
называют изменение энтальпии реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов. Значения энтальпий сгорания веществ имеются в справочной литературе. DН  для высших оксидов равно нулю.
для высших оксидов равно нулю.
С помощью термохимических расчетов можно определить энергетические эффекты многих процессов: энергию образования химической связи, энергию кристаллической решетки, энергию межмолекулярного взаимодействия, энтальпию растворения и сольватации, энтальпию фазовых переходов и т.д.
Пример 1. Вычислите энтальпию реакции СН4, г + Cl2, г = СH3Clг + НClг , используя следующие термохимические уравнения:
1. СН4, г + 2О2, г = СО2, г + 2Н2Ож , DH  = -892,0 кДж;
= -892,0 кДж;
2. 2СН3Clг + 3О2, г = 2СО2, г + 2Н2Ож + 2HClг , DH  = -1374 кДж;
= -1374 кДж;
3. 2Н2,г + О2, г = 2Н2Ож , DH  = -571,7 кДж;
= -571,7 кДж;
4. Н2, г + Сl2, г = 2НСlг , DH  = -185,0 кДж .
= -185,0 кДж .
Р е ш е н и е
Из предлагаемого набора термохимических уравнений попытаемся получить уравнение, тепловой эффект которого просят найти. Для этого необходимо сложить реакции 1 и 4 и вычесть из этой суммы реакции 2 и 3, причем в реакциях 2 и 3 коэффициенты перед веществами следует уменьшить вдвое. Таким образом, требуется провести алгебраические действия, отвечающие схеме: (1) + (4) - 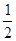 (2) -
(2) - 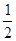 (3) .
(3) .
СН4, г + 2О2, г + Н2, г + Сl2, г - СН3Clг - 1,5О2, г - Н2,г - 0,5О2, г = СО2, г + 2Н2Ож +
+ 2НСlг - СО2, г - Н2Ож - HClг - Н2Ож .
После сокращения подобных членов и смены знаков перед веществами с минуса на плюс имеем уравнение СН4, г + Cl2, г = СH3Clг + НClг. Произведя аналогичные действия с тепловыми эффектами реакций 1- 4, получим требуемый тепловой эффект:
DH  = DH
= DH  (1) + DH
(1) + DH  (4) -
(4) - 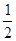 DH
DH  (2) -
(2) - 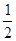 DH
DH  (3) =
(3) =
= - 892, 0 - 185,0 + 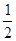 1374 +
1374 + 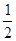 571,7 = - 104,2 кДж .
571,7 = - 104,2 кДж .
Пример 2. Вычислите DН  (N2O), если DН
(N2O), если DН  (СО2) = -393,5 кДж/моль, а DН
(СО2) = -393,5 кДж/моль, а DН  реакции Сграфит + 2N2O = CO2 + 2N2 равно -575,5 кДж.
реакции Сграфит + 2N2O = CO2 + 2N2 равно -575,5 кДж.
Р е ш е н и е
Используем второе следствие закона Гесса:
DН  = DН
= DН  (СО2) + 2DН
(СО2) + 2DН  (N2) - DН
(N2) - DН  (Сграфит) - 2DН
(Сграфит) - 2DН  (N2O)
(N2O)
или DН  = DН
= DН  (СО2) - 2DН
(СО2) - 2DН  (N2O),
(N2O),
так как стандартные энтальпии образования простых веществ N2 и Сграфит равны нулю. Выразим DН  (N2O):
(N2O):
DН  (N2O) =
(N2O) = 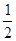 [DН
[DН  (СО2) - DН
(СО2) - DН  ] =
] = 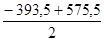 = 91 кДж/моль.
= 91 кДж/моль.
Пример 3. При взаимодействии 2,1 железа с серой выделилось 3,77 кДж тепла. Вычислите DН 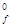 (FeS).
(FeS).
Р е ш е н и е
Запишем уравнение химической реакции: Fe + S = FeS . Следовательно, DН 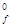 (FeS) - это тепловой эффект данной реакции в расчете на 1 моль сульфида железа (II). Учитывая, что при выделении системой тепла изменение энтальпии отрицательно, можно составить пропорцию:
(FeS) - это тепловой эффект данной реакции в расчете на 1 моль сульфида железа (II). Учитывая, что при выделении системой тепла изменение энтальпии отрицательно, можно составить пропорцию:
2,1 г Fe соответствует -3,77 кДж ,
55,8 г (1 моль Fe) соответствует DН 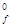 (FeS) .
(FeS) .
Тогда DН 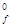 (FeS) = -
(FeS) = - 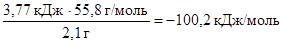 .
.
Пример 4. Вычислите DН  реакции 3Fe2O3,к + СОг = 2Fe3O4, к + СО2, г .
реакции 3Fe2O3,к + СОг = 2Fe3O4, к + СО2, г .
Р е ш е н и е
Согласно второму следствию закона Гесса
DН  = DН
= DН  (СО2, г) + 2DН
(СО2, г) + 2DН  (Fe3O4, к) - 3DН
(Fe3O4, к) - 3DН  (Fe2O3, к) - DН
(Fe2O3, к) - DН  (СOг).
(СOг).
Тогда, используя справочные данные приложения, получим
DН  = -393,5 - 2×1120 + 3×825 + 110,5 = -48,0 кДж.
= -393,5 - 2×1120 + 3×825 + 110,5 = -48,0 кДж.
Пример 5. Вычислите энтальпию реакции в стандартных условиях, используя данные об энтальпиях сгорания веществ, 2Сграфит + О2 = 2СО.
Р е ш е н и е
По третьему следствию закона Гесса, используя данные приложения, получаем:
DН  = 2DН
= 2DН  (Сгр) + DН
(Сгр) + DН  (O2) - 2DН
(O2) - 2DН  (СO) =
(СO) = 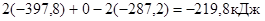
Дата добавления: 2015-04-16; просмотров: 407; Мы поможем в написании вашей работы!; Нарушение авторских прав |