
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
З А Д А Ч И. 1. Пользуясь данными приложения, рассчитайте DН реакции 2KClO3 = 2KCl + 3O2 .
1. Пользуясь данными приложения, рассчитайте DН  реакции 2KClO3 = 2KCl + 3O2 .
реакции 2KClO3 = 2KCl + 3O2 .
2.Сколько теплоты выделяется при сжигании 38 г сероугдерода?
3. Вычислите энтальпию образования озона из молекулярного кислорода, исходя из тепловых эффектов реакций:
As2O3 + O2 = As2O5; DН  = -271 кДж/моль;
= -271 кДж/моль;
As2O3 + 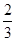 O3 = As2O5; DН
O3 = As2O5; DН  = -365 кДж/моль.
= -365 кДж/моль.
4. Определите энтальпию образования Н2О2, исходя из энтальпии образования жидкой воды и теплового эффекта реакции
Н2О2 = Н2Ож + 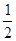 О2 ; DН
О2 ; DН  = -97,9 кДж/моль.
= -97,9 кДж/моль.
5. Вычислите энтальпию образования С3Н8, если при сгорании 11 г данного вещества выделяется 552 кДж тепла.
6. Вычислите тепловой эффект сгорания 10 дм3 С2Н4 при 27 °С и давлении 98,64 кПа.
7. Исходя из реакций
КClO3 = KCl + 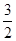 O2; DН
O2; DН  = -49,4 кДж/моль;
= -49,4 кДж/моль;
KClO4 = KCl + 2O2; DН  = 33 кДж/моль,
= 33 кДж/моль,
вычислите DН  реакции 4KClO3 = 3KClO4 + KCl.
реакции 4KClO3 = 3KClO4 + KCl.
8. При сгорании 1 дм3 ацетилена при 273 К и 101,3 кПа выделяется 58,2 кДж тепла. Вычислите DН 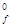 ацетилена.
ацетилена.
9. Вычислите DН 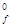 (NH4Cl), если для реакции NH3, г + HClг = NH4Clк DН
(NH4Cl), если для реакции NH3, г + HClг = NH4Clк DН  = -1075 кДж/моль.
= -1075 кДж/моль.
10. Определите DН 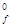 (Fe2O3), если при реакции 2Fe + Al2O3 = Fe2O3 + 2Al на каждые 80 г оксида железа (III) поглощается 426,5 кДж тепла.
(Fe2O3), если при реакции 2Fe + Al2O3 = Fe2O3 + 2Al на каждые 80 г оксида железа (III) поглощается 426,5 кДж тепла.
11. DН  реакции SO2, г + 2H2Sг = 3Sромб + 2 Н2Ож равно -234,5 кДж. Определите энтальпию образования сероводорода в стандартных условиях.
реакции SO2, г + 2H2Sг = 3Sромб + 2 Н2Ож равно -234,5 кДж. Определите энтальпию образования сероводорода в стандартных условиях.
12. Вычислите энтальпию образования сахарозы, если DН  = -5694 кДж для реакции С12Н22О11 + 12О2 = 12СО2 + 11Н2Ож .
= -5694 кДж для реакции С12Н22О11 + 12О2 = 12СО2 + 11Н2Ож .
13. Рассчитайте DН  ZnSO4, если известны тепловые эффекты реакций:
ZnSO4, если известны тепловые эффекты реакций:
2ZnS + 3O2 = 2ZnO + 2SO2; DН  = -890,0 кДж;
= -890,0 кДж;
2SO2 + O2 = 2SO3; DН  = -196,6 кДж;
= -196,6 кДж;
ZnSO4 = ZnO + SO3; DН  = 234,0 кДж .
= 234,0 кДж .
14. Чему равно количество теплоты при превращении 1 кг красного фосфора в черный, если DН  (Ркрасн) = -18,41 кДж/моль, а DН
(Ркрасн) = -18,41 кДж/моль, а DН  (Рчерн) = = ‑43,2 кДж/моль?
(Рчерн) = = ‑43,2 кДж/моль?
15. Сколько теплоты потребуется на разложение 200 г Na2CO3 до оксида натрия и диоксида углерода, если энтальпии реакций равны
Na2CO3 + SiO2 = Na2SiO3 + СО2 ; DН  = 819,29 кДж;
= 819,29 кДж;
Na2O + SiO2 = Na2SiO3; DН  = -243,5 кДж .
= -243,5 кДж .
16. Какое количество теплоты выделиться при взрыве 1,5 кг Hg(ONC)2, если разложение гремучей ртути при взрыве идет по уравнению
Hg(ONC)2 = Hg + 2CO + N2; DН  = -364,3 кДж .
= -364,3 кДж .
17. При получении азотной кислоты из KNO3 протекают следующие реакции
1) KNO3 + H2SO4 = KHSO4 + HNO3;
2) 2KNO3 + H2SO4 = K2SO4 + 2HNO3.
Каково изменение энтальпии при получении 1 кг азотной кислоты, если 80 % ее образуется по реакции (1), а DН 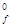 (HNO3) = -133,9 кДж/моль?
(HNO3) = -133,9 кДж/моль?
18. Пользуясь данными приложения, рассчитайте DН  реакции 3Fe2O3 + CO = 2Fe3O4 + CO2 .
реакции 3Fe2O3 + CO = 2Fe3O4 + CO2 .
19. Пользуясь данными приложения, рассчитайте DН  реакции Fe2O3 + 3CO = 2Fe + 3CO2 .
реакции Fe2O3 + 3CO = 2Fe + 3CO2 .
20. Используя стандартные энтальпии сгорания веществ, вычислите DН  реакции С2Н5ОНж + СН3СООНж = СН3СООС2Н5, ж + Н2Ож , если DН
реакции С2Н5ОНж + СН3СООНж = СН3СООС2Н5, ж + Н2Ож , если DН 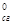 (С2Н5ОНж) = -1371 кДж/моль; DН
(С2Н5ОНж) = -1371 кДж/моль; DН 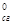 (СН3СООНж) = -874,5 кДж/моль; DН
(СН3СООНж) = -874,5 кДж/моль; DН 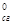 (СН3СООС2Н5) = - 2246,39 кДж/моль.
(СН3СООС2Н5) = - 2246,39 кДж/моль.
21. Сколько теплоты выделится при разложении 54 г глюкозы по реакции
С6Н12О6 = 2С2Н5ОН + 2СО2 ,
если DН  (С6Н12О6) = -1273 кДж/моль; DН
(С6Н12О6) = -1273 кДж/моль; DН  (С2Н5ОН) = -277,6 кДж/моль;
(С2Н5ОН) = -277,6 кДж/моль;
DН  (СО2) = -393,5 кДж/моль .
(СО2) = -393,5 кДж/моль .
22. Определите изменение энтальпии реакции восстановления оксида хрома (III) алюминием.
23. При сгорании 9,3 г фосфора выделяется 229,5 кДж теплоты. Вычислите DН  (Р2О5) .
(Р2О5) .
24. Вычислите изменение энтальпии реакции С2Н6 + Н2 = 2СН4 .
25. Пользуясь данными приложения, рассчитайте DН  реакции Fe3O4 + CО = 3FeO + CO2 .
реакции Fe3O4 + CО = 3FeO + CO2 .
Дата добавления: 2015-04-16; просмотров: 348; Мы поможем в написании вашей работы!; Нарушение авторских прав |