
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ЭНТРОПИЯ. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Большинство процессов представляют собой два одновременно происходящих явления: передачу энергии и изменении в упорядоченности расположения частиц относительно друг друга. Мерой неупорядоченности среди частиц в системе служит функция состояния называемая энтропия S. В отличие от других функций состояния, можно определить не только изменение энтропии DS, но и абсолютное значение энтропии S.
Абсолютное значение энтропии можно вычислить по уравнению Больцмана (  ): S = R×lnW,
): S = R×lnW,
где R - универсальная газовая постоянная; W - термодинамическая вероятность, которая показывает число микросостояний системы, при помощи которых может реализоваться определенное макросостояние.
При переходе вещества из твердого состояния в жидкое и далее в газообразное значительно увеличивается неупорядоченность частиц, поэтому Sгаза >> Sж > Sтв . У веществ в аморфном состоянии энтропия будет больше, чем в кристаллическом, так как кристалл более упорядоченная структура. Например, для стекловидного и кристаллического SiO2 значения энтропии равны 46,9 и 42,7  соответственно. При одинаковом агрегатном состоянии энтропия тем выше, чем больше атомов содержится в молекуле. Так, энтропии газообразных О, О2 и О3 равны соответственно 161, 205 и 239
соответственно. При одинаковом агрегатном состоянии энтропия тем выше, чем больше атомов содержится в молекуле. Так, энтропии газообразных О, О2 и О3 равны соответственно 161, 205 и 239  .
.
Энтропии многих веществ определены при стандартных условиях и приведены в справочной литературе (см. приложение). Энтропию при этих условиях называют стандартной энтропией и обозначают S  .
.
Расчет DS  химической реакции осуществляют так же, как и изменение энтальпии реакции. Для реакции общего вида aA + bB = dD + fF
химической реакции осуществляют так же, как и изменение энтальпии реакции. Для реакции общего вида aA + bB = dD + fF
DS  = d S
= d S  (D) + f S
(D) + f S  (F) - a S
(F) - a S  (A) - b S
(A) - b S  (B).
(B).
Об изменении энтропии в химической реакции можно судить по изменению объема системы в ходе реакции. Если объем системы увеличивается, то DS  > 0, а если реакция протекает с уменьшением объема, то энтропия также уменьшается (DS
> 0, а если реакция протекает с уменьшением объема, то энтропия также уменьшается (DS  < 0). Для реакций между твердыми веществами изменения энтропии практически не происходит. То же относится и к процессам, в которых число моль газообразных веществ не изменяется.
< 0). Для реакций между твердыми веществами изменения энтропии практически не происходит. То же относится и к процессам, в которых число моль газообразных веществ не изменяется.
Процессы, протекающие без подвода энергии от внешнего источника, называют самопроизвольными. Согласно второму закону термодинамики, в изолированной системе самопроизвольно идут только такие процессы, которые сопровождаются увеличением энтропии. Таким образом, знак DS является критерием направления протекания процессов в изолированных системах.
Если DS > 0, то процесс протекает самопроизвольно в прямом направлении, при DS < 0 направление самопроизвольного протекания процессов обратное. В случае, когда DS = 0, изолированная система находится в состоянии равновесия.
Пример 1. Какой знак будет иметь изменение энтропии для реакции
N2, г + 2О2, г = 2NO2, г?
Сопоставьте вывод с результатами расчетов, если S  участников реакции равны: N2 - 191,5; O2 - 205,0; NO2 - 240,2
участников реакции равны: N2 - 191,5; O2 - 205,0; NO2 - 240,2 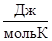 .
.
Р е ш е н и е
Данная реакция протекает с уменьшением числа моль газов (в исходных веществах - 3 моль, а в продуктах - 2 моль), то есть с уменьшением объема. Поэтому ожидаем, что DS  < 0. Вычислим изменение энтропии в стандартных условиях
< 0. Вычислим изменение энтропии в стандартных условиях
DS  = 2S
= 2S  (NO2) - S
(NO2) - S  (N2) - 2S
(N2) - 2S  (O2) =
(O2) = 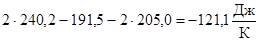 .
.
По результатам расчета получили также DS  < 0.
< 0.
Пример 2.Укажите знак изменения энтропии при плавлении льда.
Р е ш е н и е
При плавлении льда вода из твердого состояния переходит в жидкое. Поскольку Sж > Sтв, то DSпл = Sж - Sтв > 0.
Дата добавления: 2015-04-16; просмотров: 314; Мы поможем в написании вашей работы!; Нарушение авторских прав |