
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
З А Д А Ч И. 1. В каком направлении при стандартных условиях будет протекать реакция N2, г + О2, г = 2NO г?
1. В каком направлении при стандартных условиях будет протекать реакция N2, г + О2, г = 2NO г? Ответ подтвердите расчетами.
2. В каком направлении при стандартных условиях будет протекать реакция N2О г + NО2, г = 3NO г? Ответ подтвердите расчетами.
3. В каком направлении при стандартных условиях будет протекать реакция N2O г + NО = NO2,г + N2, г? Ответ подтвердите расчетами.
4. Можно ли при стандартных условиях восстановить водородом оксиды CuO и PbO? Ответ объясните.
5. Возможно ли получение свинца из оксида свинца (II) путем его восстановления графитом и при какой температуре?
6. Вычислите изменение энергии Гиббса реакции при 1000 К, если DН  = 131,3 кДж, а DS
= 131,3 кДж, а DS  = 133,6 Дж/К (влиянием Т на DН и DS пренебречь).
= 133,6 Дж/К (влиянием Т на DН и DS пренебречь).
7. Вычислите изменение DG реакции при 298 К 2Н2Ог + Сгр = 2Н2 + СО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак DG данной реакции?
8. Вычислите DS  , DН
, DН  и DG
и DG  для реакции NH4Clк = NH3, г + HClг . Как влияет температура на направление протекания данной реакции?
для реакции NH4Clк = NH3, г + HClг . Как влияет температура на направление протекания данной реакции?
9. Какая из приведенных реакций термодинамически более вероятна
1) 4NH3 + 3O2 = 2N2 + 6H2Oг; 2) 4NH3 + 5O2 = 4NO + 6H2Oг .
Ответ подтвердите расчетами.
10. Определите направление самопроизвольного протекания реакции при стандартных условиях SO2 + 2H2 = Sкр + 2H2Oг .
11. Вычислите изменение DG реакции при 298 К ZnS + 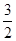 O2 = ZnO + SО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак DG данной реакции?
O2 = ZnO + SО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак DG данной реакции?
12. Вычислите изменение энергии Гиббса реакции при 1500 К, если DН  = 221,0 кДж, а DS
= 221,0 кДж, а DS  = 53,2 Дж/К (влиянием Т на DН и DS пренебречь).
= 53,2 Дж/К (влиянием Т на DН и DS пренебречь).
13. Определите температуру равновероятного протекания реакции в прямом и обратном направлении, если DН = 138 кДж, а DS = 105  .
.
14. Какая из приведенных реакций термодинамически более вероятна
1) N2 + O2 = 2NО; 2) N2 + 2O2 = 2NO2 .
Ответ подтвердите расчетами.
15. Вычислите DS  , DН
, DН  и DG
и DG  для реакции СО2 = Сгр + О2 . Как влияет температура на направление протекания данной реакции?
для реакции СО2 = Сгр + О2 . Как влияет температура на направление протекания данной реакции?
16. Возможно ли получение цинка из оксида цинка (II) путем его восстановления графитом и при какой температуре?
17. При какой температуре начнется реакция PbOк + СО = Pbк + СО2? Влиянием температуры на DН и DS пренебречь.
18. Определите направление самопроизвольного протекания реакции при стандартных условиях СO2 + 2H2 = Сгр + 2H2Oг.
19. Вычислите изменение DG реакции при 298 К FeS + 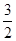 O2 = FeO + SО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак DG данной реакции?
O2 = FeO + SО2. Действием какого фактора - энтальпийного или энтропийного - определяется знак DG данной реакции?
20. Вычислите DG  и DG
и DG  для реакции Н2Ог + Сгр = СОг + Н2, г . Как влияет температура на термодинамическую вероятность протекания процесса в прямом направлении?
для реакции Н2Ог + Сгр = СОг + Н2, г . Как влияет температура на термодинамическую вероятность протекания процесса в прямом направлении?
21. Можно ли при стандартных условиях восстановить водородом оксиды ZnO и NiO? Ответ объясните.
22. Вычислите DG  реакции двумя способами 2Fe + Al2O3 = Fe2O3 + 2 Al.
реакции двумя способами 2Fe + Al2O3 = Fe2O3 + 2 Al.
23. Определите температуру равновероятного протекания реакции в прямом и обратном направлении, если DН = 38 кДж, а DS = 207  .
.
24. В каком направлении при стандартных условиях будет протекать реакция СН4, г + 2О2, г = СО2, г + 2Н2Ож ? Ответ подтвердите расчетами.
25. Вычислите изменение энергии Гиббса реакции при 2000 К, если DН  = 242,3 кДж, а DS
= 242,3 кДж, а DS  = 195,6 Дж/К (влиянием Т на DН и DS пренебречь).
= 195,6 Дж/К (влиянием Т на DН и DS пренебречь).
Дата добавления: 2015-04-16; просмотров: 336; Мы поможем в написании вашей работы!; Нарушение авторских прав |