
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Контрольная работа 1. Химическая термодинамика
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 15
1. Какое из двух неравенств ΔS˚298 > 0 или ΔS˚298 < 0 отвечает изменению энтропии в процессах:
а) плавления льда;
б) кипения воды;
в) синтеза аммиака.
Ответ поясните.
2. Возможно ли самопроизвольное протекание следующей реакции:
2Hg2Cl2 ® 2HgCl2 + 2Hg
Ответ подтвердите, рассчитав ΔrG˚298 этой системы.
3. Какое количество теплоты выделяется при превращении 1 кг красного фосфора в чёрный, если ΔfН˚298 (Р красный) = -17,45 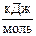 , а ΔfН˚298 (Р чёрный) = -43,20
, а ΔfН˚298 (Р чёрный) = -43,20 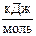 .
.
4. В какую сторону сместится равновесие процесса:
2СО (г) « СО2 (г) + С (гр); ΔrН˚298 = -172,4 кДж
при повышении температуры, при повышении давления?
5. Разложение NO2 на поверхности золота при высоких температурах протекает по уравнению: 2N2O ® 2N2 + O2. Константа скорости данной реакции равна 5,1×10-4  при 1173 К. Начальная концентрация N2O равна 3,2
при 1173 К. Начальная концентрация N2O равна 3,2 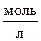 . Определите скорость реакции при заданной температуре в начальный момент времени и в тот момент, когда разложится 25% N2O.
. Определите скорость реакции при заданной температуре в начальный момент времени и в тот момент, когда разложится 25% N2O.
6. Определите равновесную концентрацию водорода в реакции: 2HI « H2 + I2, если исходная концентрация HI составляет 0,55 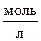 , а константа равновесия Кс = 0,12.
, а константа равновесия Кс = 0,12.
Дата добавления: 2015-04-16; просмотров: 236; Мы поможем в написании вашей работы!; Нарушение авторских прав |