
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Контрольная работа 1. Химическая термодинамика
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 11
1. Как должна изменится энтропия при эндотермическом процессе, чтобы он мог протекать самопроизвольно?
2. Определите стандартную теплоту образования сероуглерода CS2, используя тепловой эффект следующей реакции:
CS2 (ж) + 3О2 (г) ® СО2 (г) + 2SO2 (г); ΔrН˚298 = -1075 кДж.
3. Определите ΔrG˚298 реакции, протекающей по уравнению:
4NH3 (г) + 5О2 (г) ® 4NO (г) + 6Н2О (г).
Вычисления сделайте на основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ. Возможна ли эта реакция в стандартных условиях?
4. При определённых условиях реакция хлороводорода с кислородом является обратимой:
4HCl (г) + О2 (г) « 2Cl2 (г) + 2Н2О (г); ΔrН = -116,4 кДж.
Какое влияние на равновесие системы окажут:
– увеличение давления,
– повышение температуры,
– введение катализатора?
5. При температуре 30°С реакция протекает за 25 мин, при 50°С – за 4 мин. Рассчитайте температурный коэффициент скорости реакции.
6. При состоянии равновесия системы: СО (г) + Сl2 (г) « COCl2 (г) концентрация оксида углерода (II) равна 3 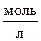 ; хлора – 0,3
; хлора – 0,3 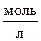 ; фосгена – 2
; фосгена – 2 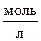 . Вычислите исходную концентрацию хлора и константу равновесия.
. Вычислите исходную концентрацию хлора и константу равновесия.
Дата добавления: 2015-04-16; просмотров: 215; Мы поможем в написании вашей работы!; Нарушение авторских прав |