
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Контрольная работа 1. Химическая термодинамика
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 5
1. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
С (гр) + СО2 (г) ® 2СО (г);
N2 (г) + 2О2 (г) ® 2NO2 (г);
N2 (г) + О2 (г) ® 2NO (г).
Почему в этих реакциях ΔrS˚298 имеет значения >0, <0, »0?
2. В каком направлении нижеприведённая реакция будет протекать самопроизвольно:
Fe2O3 (кр) + 3Н2 (г) « 2Fe (кр) + 3Н2О (г)
Необходимые для расчёта ΔrG˚298 реакции значения ΔfH˚298 и S˚298 веществ – участников реакции возьмите из справочника.
3. Тепловой эффект реакции: SO2 (г) + 2Н2S (г) ® 3S (ромб) + 2Н2О (ж)
равен –234,50 кДж. Определите стандартную теплоту образования H2S.
4. Какие вещества называются катализаторами? Что такое положительный и отрицательный катализаторы? Как влияет катализатор на скорость химической реакции, на истинное равновесие?
5. Определите энергию активации реакции, если при изменении температуры от 330 до 400 К константа скорости реакции увеличилась в 105 раз.
6. Вычислите константу равновесия реакции: СО (г) + Н2О (г) « СО2 (г) + Н2 (г)
если начальные концентрации веществ ( 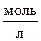 ):
):
С(СО) = 0,01; С(Н2О) = 0,02; С(Н2) = 0,01; С(СО2) = 0,01.
Концентрация СО в состоянии равновесия равна 0,007 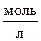 .
.
Дата добавления: 2015-04-16; просмотров: 294; Мы поможем в написании вашей работы!; Нарушение авторских прав |