
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Контрольная работа 1. Химическая термодинамика
Контрольная работа 1
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 1
1. Что называется внутренней энергией, энтальпией?
2. Определите количество теплоты, выделяющееся при гашении 100 кг извести водой при 25 °С, если известны стандартные теплоты образования веществ, участвующих в химической реакции:
ΔfH˚298 (CaO кр) = -635,1 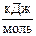 ;
;
ΔfH˚298 (Н2О ж) = -285,84 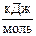 ;
;
ΔfH˚298 (Ca(OН)2 кр) = -982,2 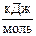 .
.
3. Исходя из ΔfG˚298 соединений, участвующих в реакции, определите, возможна ли реакция:
Al2O3 (кр) + 3SO3 (г) ® Al2(SO4)3 (кр)
4. В какую сторону сместится равновесие реакции:
NiO (кр) « Ni (кр) + 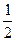 O2 (г) – Q; ΔrH = 262 кДж
O2 (г) – Q; ΔrH = 262 кДж
при понижении температуры, при понижении давления?
5. Во сколько раз изменится константа скорости реакции при увеличении температуры от 500 до 1000 К, если энергия активации равна 95,5 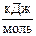 .
.
6. Вычислите константу равновесия химической реакции:
2SO2 (г) + O2 (г) « 2SO3 (г),
протекающей в закрытом сосуде при постоянной температуре. Начальные концентрации веществ равны ( 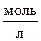 ): С(SO2) = 0,08; C(O2) = 0,06. К моменту наступления равновесия в смеси остаётся 20% первоначального количества SO2.
): С(SO2) = 0,08; C(O2) = 0,06. К моменту наступления равновесия в смеси остаётся 20% первоначального количества SO2.
Контрольная работа 1
Дата добавления: 2015-04-16; просмотров: 240; Мы поможем в написании вашей работы!; Нарушение авторских прав |