
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Контрольная работа 1. Химическая термодинамика
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 12
1. Сформулируйте закон Гесса и следствия из него. Приведите примеры использования закона Гесса.
2. Определите тепловой эффект реакции: CaO (кр) + СО2 (г) ® СаСО3 (кр), если при взаимодействии 140 г оксида кальция с углекислым газом выделяется 444 кДж теплоты.
3. Укажите, будет ли процесс 2Al (кр) + Fe2O3 (кр) ® 2Fe (кр) + Al2O3 (кр) протекать самопроизвольно. Значения ΔfH˚298 и S˚298, необходимые для расчёта ΔrG˚298 найдите в справочнике.
4. Каким из указанных ниже способов можно увеличить выход водяного пара в реакции:
СО2 (г) + Н2 (г) « СО (г) + Н2О (г); ΔrН = -0,8 кДж
а) увеличить давление,
б) уменьшить давление,
в) увеличить концентрацию водорода,
г) уменьшить концентрацию углекислого газа.
5. Энергия активации реакции: 2HI (г) ® Н2 (г) + I2 (г) равна 186,4 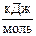 . Рассчитайте константу скорости этой реакции при 700 К, если при 456 К константа скорости равна 0,942×10-6
. Рассчитайте константу скорости этой реакции при 700 К, если при 456 К константа скорости равна 0,942×10-6  .
.
6. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции: 2NO2 « 2NO + O2 установилось при концентрации диоксида азота, равной 0,8 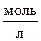 ; оксида азота – 2,2
; оксида азота – 2,2 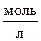 ; кислорода – 1,1
; кислорода – 1,1 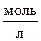 . Вычислите константу равновесия реакции для этой температуры и исходную концентрацию диоксида азота.
. Вычислите константу равновесия реакции для этой температуры и исходную концентрацию диоксида азота.
Дата добавления: 2015-04-16; просмотров: 230; Мы поможем в написании вашей работы!; Нарушение авторских прав |