
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Контрольная работа 1. Химическая термодинамика
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 9
1. В каких случаях возможно самопроизвольное протекание химической реакции, если принять ½DH°½<< ½TDS°½?
2. Тепловой эффект реакции:
SO2 (г) + 2H2S (г) ® 3S (ромб) + 2Н2О (ж)
равен –234,50 кДж. Определите стандартную теплоту образования H2S.
3. Используя значения ΔfG˚298 соединений, участвующих в реакции:
C6H6 (ж) + NH3 (г) ® С6Н5NH2 (ж) + Н2 (г),
определите, возможна ли эта реакция, ΔfG˚298 (С6Н5NH2 ж) = 149,08 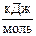 .
.
4. Выведите уравнение константы химического равновесия для реакции:
MgO (кр) + СО2 (г) « MgCO3 (кр); DrH° < 0.
Какими способами можно сместить химическое равновесие этой системы влево?
5. При 398 К реакция заканчивается за 18 мин. Через сколько времени эта реакция закончится при 453 К, если температурный коэффициент скорости реакции равен 3?
6. Равновесие реакции: H2 (г) + Cl2 (г) « 2НCl (г) установилось при следующих концентрациях участвующих в ней веществ: ( 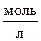 ): [Н2] = 0,25; [Cl2] = 0,05; [HCl] = 0,9. Определите исходные концентрации хлора и водорода.
): [Н2] = 0,25; [Cl2] = 0,05; [HCl] = 0,9. Определите исходные концентрации хлора и водорода.
Контрольная работа 1
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 10
1. Уменьшится или увеличится энтропия при переходе водяного пара в жидкость, кристаллического йода в парообразное состояние? Почему? Вычислите DS° для каждого превращения.
2. Определите ΔfH˚298 (Fe2O3 кр), если при реакции:
2Fe (кр) + Al2O3 (кр) ® Fe2O3 (кр) + 2Al (кр)
на каждые 80 г Fe2O3 поглощается 426,5 кДж теплоты.
3. Рассчитайте ΔrG˚298 реакции: N2 (г) + 2H2O (г) ® NH4NO2 (г) и сделайте вывод о возможности её протекания. ΔfG˚298 (NH4NO2 г) = 115,94 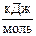 .
.
4. Выведите уравнение константы химического равновесия для реакции:
MgO (кр) + СО2 (г) « MgCO3 (кр); DrH° < 0.
Какими способами можно сместить химическое равновесие этой системы влево?
5. Вычислите температурный коэффициент некоторой реакции, если константа скорости этой реакции при 120°С равна 5,88×10-4, а при 170°С – 6,7×10-2.
6. Равновесные концентрации веществ – участников реакции:
СН3СООН (ж) + С2Н5ОН (ж) ® СН3СООС2Н5 (ж) + Н2О (ж)
равны соответственно ( 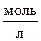 ): [СН3СООН ж] = 0,02; [С2Н5ОН ж] = 0,32; [СН3СООС2Н5 ж] = 0,08; [Н2О ж] = 0,08. Какими стали равновесные концентрации после смещения равновесия вследствие увеличения концентрации С2Н5ОН в 4 раза?
): [СН3СООН ж] = 0,02; [С2Н5ОН ж] = 0,32; [СН3СООС2Н5 ж] = 0,08; [Н2О ж] = 0,08. Какими стали равновесные концентрации после смещения равновесия вследствие увеличения концентрации С2Н5ОН в 4 раза?
Дата добавления: 2015-04-16; просмотров: 333; Мы поможем в написании вашей работы!; Нарушение авторских прав |