
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Рекомендации к изучению теоретического материала. Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами
6.1.1 Слабые электролиты. Константа и степень диссоциации
Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами. Для них степень диссоциации - меньше 30%. В их растворах устанавливается равновесие между недиссоциированными молеку-лами и продуктами их диссоциации – ионами. Поскольку электролитическая диссоциация является равновесным процессом, подчиняющимся закону действия масс, то для слабых электролитов этот процесс можно описать с по-мощью константы равновесия, называемой константой диссоциации. Между константой диссоциации ( Кд), степенью диссоциации (a) и началь-ной концентрацией (С0) слабого электролита существует взаимосвязь, уста-новить которую можно следующим образом:
Концентрации, СМ (моль/л) 
Исходные С0 - -
В диссоциации a×С0 m×a×C0 n×a×C0
Равновесные С0(1-a) m×a×C0 n×a×C0
Записываем выражение константы диссоциации и подставляем в него равновесные концентрации:

Для бинарного электролита типа АК (m = n = 1) это уравнение имеет вид:  . Чтобы определить a, необходимо решить квадратное уравнение С×a2 + К×a - К = 0 (
. Чтобы определить a, необходимо решить квадратное уравнение С×a2 + К×a - К = 0 (  , где a принимает только положительные значения). Если отношение концентрации слабого электролита к его константе диссоциации составляет:
, где a принимает только положительные значения). Если отношение концентрации слабого электролита к его константе диссоциации составляет:  , то a в этом случае стремится к нулю и взаимосвязь между этими величинами может быть представлена в виде: КД = С × a2 (закон разбавления Оствальда в его приближенном варианте). Отсюда
, то a в этом случае стремится к нулю и взаимосвязь между этими величинами может быть представлена в виде: КД = С × a2 (закон разбавления Оствальда в его приближенном варианте). Отсюда  . Это соотношение показывает, что при разбавлении раствора (т.е. при уменьшении концентрации электро-лита С) степень диссоциации электролита возрастает. Если электролитом является слабая кислота НА, то концентрации ионов Н+ и А- равны [H+] = [A-] = C×a =
. Это соотношение показывает, что при разбавлении раствора (т.е. при уменьшении концентрации электро-лита С) степень диссоциации электролита возрастает. Если электролитом является слабая кислота НА, то концентрации ионов Н+ и А- равны [H+] = [A-] = C×a = 
В растворах многоосновных кислот устанавливается несколько равно-весий, каждое из которых отвечает определенной ступени диссоциации мно-гоосновной кислоты и характеризуется соответствующей константой. Так, трем ступеням ортофосфорной кислоты отвечают три константы диссоци-ации:
Н3РО4 ⇄ Н+ + Н2РО4- (К1 = 7,6 ×10-3)
Н2РО4- ⇄ Н+ + НРО42- (К2 = 6,2 × 10-8)
НРО42- ⇄ Н+ + РО43- (К3 = 1,3 × 10-12).
Поскольку К1 >> К2 >> К3, то в наибольшей степени протекает диссоциация по первой ступени, а при переходе к каждой последующей стадии степень диссоциации, как правило, резко уменьшается.
6.1.2 Сильные электролиты. Активность ионов
В растворах сильных электролитов концентрация ионов довольно велика, так что силы межионного взаимодействия заметно проявляются даже при малой концентрации электролита. В результате ионы оказываются не вполне свободными, так как в процессе диссоциации сильных электролитов образуются гидратированные ионы и ионные пары. Поэтому для описания состояния ионов в растворе пользуются, наряду с концентрацией ионов, их активностью, т.е. условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а (моль/л) связана с его молярной концентрацией в растворе СМ соот-ношением а = f × CМ, где f – коэффициент активностииона (безразмерная величина).
Коэффициенты активности ионов зависят от состава и концентрации раствора, от заряда и природы иона и от других условий. Однако в разбавленных растворах (  моль/л) природа иона слабо сказывается на величине его коэффициента активности. Приближенно можно считать, что в разбавленных растворах коэффициент активности иона в данном раство-рителе зависит только от заряда иона и ионной силы раствора m, которая равна полусумме произведений концентрации СМ каждого иона на квадрат его заряда z:
моль/л) природа иона слабо сказывается на величине его коэффициента активности. Приближенно можно считать, что в разбавленных растворах коэффициент активности иона в данном раство-рителе зависит только от заряда иона и ионной силы раствора m, которая равна полусумме произведений концентрации СМ каждого иона на квадрат его заряда z:  .
.
Коэффициент активности иона f, заряд которого z, при средней вели-чине ионной силы определяется по формуле Дебая и Гюккеля  , если m<0,01, то можно пользоваться приближенной форму-лой
, если m<0,01, то можно пользоваться приближенной форму-лой  .
.
Существует взаимосвязь между коэффициентами активностей катиона и аниона электролита (  ) и средним коэффициентом активности:
) и средним коэффициентом активности: 
6.1.3 Ионное произведение воды. Вычисление рН растворов сильных и слабых кислот и оснований
Вода является слабым электролитом. Константа диссоциации воды при 22 оС составляет  . Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной общей концентрации воды, которая составляет 1000/18 = 55,55 моль/л. Тогда [H+]×[OH-] = K×[H2O] = 1,8×10-16 × 55,55 = 1× 10-14 =KW.
. Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной общей концентрации воды, которая составляет 1000/18 = 55,55 моль/л. Тогда [H+]×[OH-] = K×[H2O] = 1,8×10-16 × 55,55 = 1× 10-14 =KW.
Для воды и ее растворов произведение концентраций ионов Н+ и ОН--
величина постоянная при данной температуре. Она называется ионным произведением воды KWи при 22 0С составляет 1×10-14. Строго говоря, постоянной величиной является произведение не концентраций, а активнос-тей ионов Н+ и ОН-:  Однако в разбавленных растворах, где коэффициенты активности близки к единице, этим различием при не очень точных расчетах можно пренебречь.
Однако в разбавленных растворах, где коэффициенты активности близки к единице, этим различием при не очень точных расчетах можно пренебречь.
Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов Н+, если известна концентрация ионов ОН-, и наоборот:  Вместо концентраций ионов Н+ и ОН- удобнее пользоваться их десятичными логарифмами, взятыми с обратным знаком; эти величины обозначаются символами рН и рОН и называются соответственно водородным и гидроксильным показателями: рН = -lg [H+]; pOH = -lg [OH-]. Согласно теории сильных электролитов, следует пользо-ваться активностью этих ионов и тогда
Вместо концентраций ионов Н+ и ОН- удобнее пользоваться их десятичными логарифмами, взятыми с обратным знаком; эти величины обозначаются символами рН и рОН и называются соответственно водородным и гидроксильным показателями: рН = -lg [H+]; pOH = -lg [OH-]. Согласно теории сильных электролитов, следует пользо-ваться активностью этих ионов и тогда 

Логарифмируя соотношение [H+]×[OH-] =10-14 и меняя знаки на обратные, получим: рН + рОН = 14.
С концентрацией ионов Н+ и ОН- связано определение кислотно-ос-новного характера среды: кислая([H+] > 10-7 моль/л или рН <7),ней-тральная ([H+] = [OH-] = 10-7 моль/л или рН = 7)ищелочная([H+]<10-7 моль/л или рН > 7) среда.
При необходимости более точных расчетов для характеристики состо-яния ионов Н+ в растворе следует вычислять 
Например, определить активность ионов водорода и рН в 2,5×10-3 М растворе HCl, содержащем, кроме того, 2,5×10-3 моль/л KCl.
Решение. Для электролитов, состоящих из однозарядных ионов, значение ионной силы численно равно общей концентрации раствора; в данном случае m = 2,5×10-3 + 2,5×10-3 = 5×10-3. При этой ионной силе коэффициент активности иона Н+ определяется по упрощенной формуле  и принимает значение
и принимает значение  . Следовательно,
. Следовательно,  моль/л. Значение рН составляет:
моль/л. Значение рН составляет: 
6.1.4 Гетерогенные равновесия. Произведение растворимости
В насыщенном растворе малорастворимого сильного электролита уста-навливается равновесие между осадком (твердой фазой) электролита и иона-ми электролита в растворе, например:
СА(тв.) ⇄ СА(р) ⇄ С(р)+ + А-(р)
В этой системе имеют место три равновесия, характеризующиеся своими константами:
СА(тв.) ⇄ СА(р) К0 = [CA]p;
CA(p) ⇄ C(p)+ + A(p)- 
CA(тв) ⇄ C(p)+ + A(p)- ПР = [C+] ×[A-].
Эти константы взаимосвязаны следующим образом: 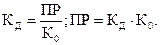
Переход ионов в раствор и обратный процесс – внедрение ионов в кристаллическую структуру твердого вещества – происходит лишь на его поверхности, которая при данной степени измельчения является постоянной величиной. В таком случае на основании закона действия масс состояние равновесия зависит только от произведения концентраций ионов, которое для данного малорастворимого электролита является величиной постоянной.
Поскольку в растворах сильных и средних электролитов состояние ионов определяется их активностями, то константа третьего равновесия выразится уравнением:  . Отсюда следует, что произведение активностей ионов представляет собой постоянную величину, называемую произведением растворимостии обозначаемую ПР.
. Отсюда следует, что произведение активностей ионов представляет собой постоянную величину, называемую произведением растворимостии обозначаемую ПР.
Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе (произведение растворимости), есть величина постоянная при данной температуре.
Например, для процесса СаСО3 (тв.) ⇄ Са2+ + СО32-  . В общем виде для малорастворимого электролита КmAn выражение ПР записывается с учетом стехиометрических коэффициентов m и n: KmAn ⇄ m×Kn+ + n×Am-;
. В общем виде для малорастворимого электролита КmAn выражение ПР записывается с учетом стехиометрических коэффициентов m и n: KmAn ⇄ m×Kn+ + n×Am-;  .
.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие смещается в сторону образова-ния осадка. Таким образом, условием образования осадка является пре-вышение произведения концентраций ионов (  ) мало-растворимого электролита над его произведением растворимости.
) мало-растворимого электролита над его произведением растворимости.
Если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), то равновесие сместится в сторону растворения осадка. Следовательно, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР.
Добавление хорошо растворимого сильного электролита к насы-щенному раствору малорастворимого электролита с общим для них ионом действует двояко. С одной стороны, увеличение концентрации общего иона влечет за собой уменьшение растворимости малорастворимого соединения, а с другой - благодаря увеличению ионной силы раствора растворимость несколько увеличивается. Последнее явление получило название солевого эффекта.
Исходя из значений ПР, можно вычислять растворимость малорас-творимых электролитов в воде и растворах, содержащих другие электролиты. Для этого обозначим S (моль/л) растворимость электролита KmAn. Тогда из уравнения диссоциации:
KmAn « m×Kn+ × n×Am-
S m×S n×S

 Для бинарного электролита типа КА при m = n = 1 растворимость его
Для бинарного электролита типа КА при m = n = 1 растворимость его 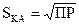 , а для электролита К2А3
, а для электролита К2А3 
Дата добавления: 2014-11-13; просмотров: 497; Мы поможем в написании вашей работы!; Нарушение авторских прав |