
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Рассмотрим теперь химическое равновесие в системе

Равновесие имеет динамический характер. Поэтому выражение (7.30) можно получить, приравняв скорости прямой и обратной реакции в условиях равновесия:

Откуда

И получаем известное уравнение Вант-Гоффа

|
Экспериментальное изучение скорости прямой реакции показывает

|
Механизм реакции известен:

|

|
Скорость прямой реакции по этому механизму соответствует опытной скорости. Создаётся впечатление, что два опытных факта -

|
| противоречат друг |
| - И1 |
постоянство отношения
другу. Понять, что противоречия здесь нет, позволяет принцип детального равновесия.
В условиях равновесия каждому прямому процессу должен соответствовать обратный, идущий с той же скоростью.Поэтому в равновесии каждую из приведённых реакций нужно записать как обратимую:

|

|

|
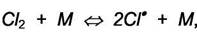
|
1)

|
2)

|
3)
Видно, что сумма реакций 2) и 3) даёт исходную реакцию и, следовательно,

Это выражение полностью соответствует формуле (7.30). Механизм образования  мог бы быть и другим, но выражение
мог бы быть и другим, но выражение
для КС останется тем же. Вид его не зависит от кинетики, так как в равновесной системе выполняется принцип детального равновесия, т.е. каждому прямому процессу соответствует обратный, идущий с той же скоростью.
Допустим, например, что фосген образуется так

|

|

|

|
| А) |
| C2O2, |
| B) |

Таким образом, можно сделать вывод, что выражение для константы равновесия не зависит от кинетического механизма химического превращения.
Дата добавления: 2014-12-23; просмотров: 266; Мы поможем в написании вашей работы!; Нарушение авторских прав |