
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические свойства. 1.2.1. Реакции с участием связи O−H
1.2.1. Реакции с участием связи O−H
Кислотные свойства. В молекуле спирта содержится атом водорода, связанный с сильно электроотрицательным кислородом, поэтому спирт проявляет заметную кислотность.
Спирты (кроме метанола) более слабые кислоты, чем вода: алкильная группа, проявляя электронодонорный индукционный эффект, подает электроны на кислород R→Оy, увеличивает на нем отрицательный заряд (по сравнению с зарядом на гидроксид-ионе) и делает алкоксид-ион R→Оy - сопряженное основание - более сильным, а кислоту - более слабой.

|

Кислотные свойства спиртов убывают в ряду:
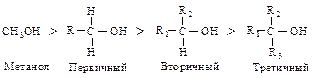
Основность. Спирты представляют собой основания, сравнимые по силе с водой. При действии сильных кислот они превращаются в соли.

Взаимодействие с магнийгалогеналкилами. В этой реакции происходит замещение гидроксильного водорода на магнийгалоген и выделяется углеводород.

В случае использования СН3MgJ выделяется метан. По объему выделившегося метана определяют количественное содержание гидроксильных групп.
Образование сложных эфиров. Благодаря наличию электронной пары на атоме кислорода спирт является нуклеофильным реагентом. В качестве нуклеофила он выступает в реакциях образования сложных эфиров. Спирт может атаковать электронодефицитный атом углерода карбонильной группы хлорангидридов, ангидридов кислот и кислот (реакция ацилирования спирта).
|


1.2.2. Реакция с участием связи R–OH
Электроотрицательный кислород, оттягивая общую пару электронов связи  , создает частичный положительный заряд науглероде иэтот атом углерода может подвергаться атаке нуклеофила:
, создает частичный положительный заряд науглероде иэтот атом углерода может подвергаться атаке нуклеофила:  .
.
Образование алкилгалогенидов. Спирты легко реагируют с галогеноводородами (HCl, HBr, HI). Реакционная способность падает в ряду НI > HBr > HCl.

Сухой газообразный галогеноводород пропускают в спирт или спирт нагревают с концентрированным раствором галогеноводорода. Реакция катализируется кислотами. Спирт, присоединяя протон, превращается в ион алкилоксония, который гораздо легче отщепляет нейтральную молекулу воды (“хорошая” уходящая группа), чем спирт – ион ОНy (“плохая” уходящая группа).

Метиловый и первичные спирты реагируют по механизму SN2.
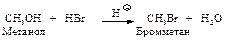
Механизм:сначала происходит протонирование спирта  , а затем атака нуклеофилом Bryатома углеродас образованием переходного состояния и последующее отщепление молекулы воды:
, а затем атака нуклеофилом Bryатома углеродас образованием переходного состояния и последующее отщепление молекулы воды:
|

Вторичные и третичные спирты взаимодействуют с галогеноводородами по механизму SN1.

Механизм: 
1 стадия, медленная: 
2 стадия, быстрая: 
Поскольку реакции замещения у вторичных и третичных спиртов протекают через стадию образования карбониевого иона, возможна перегруппировка.

Механизм перегруппировки:

Реакционная способность спиртов по отношению к галогенводородам изменяется следующим образом:
|

SN1 SN2
| Устойчивость карбокатионов возрастает, реакционная способность увеличивается | Пространственные препятствия для атаки реакционного центра уменьшаются, реакционная способность увеличивается |
Реакция с галогенидами фосфора PCl5, PCl3, PBr3, PI3, тионилхлоридом SOCl2. Для получения алкилгалогенидов используют реакции спиртов с галогенидами фосфора и тионилхлоридом, они не сопровождаются перегруппировками.



Механизм реакции спирта с тионилхлоридом. Взаимодействие одного моля спирта с одним молем тионилхлорида приводит к нестойкому алкилхлорсульфиту.

В присутствии основания, обычно пиридина, происходит инверсия путем атаки хлорид-иона на хлорсульфит.
|


Однако при проведении синтеза в эфире в отсутствии основания создаются условия для сохранения конфигурации. Частица yОSOCl вытесняется из хлорсульфита и при этом создается тесная ионная пара, в которой атом хлора с фронта (со стороны уходящей группы) атакует углеродный атом.

Такой тип реакций называют внутримолекулярным (интрамолекулярным) замещением и обозначают символом SNi.
Образование простых эфиров – межмолекулярная дегидратация. Межмолекулярная дегидратация спиртов служит примером нуклеофильного замещения, в котором субстратом является протонированная молекула спирта, а другая молекула ROH служит нуклеофилом.
Первичные спирты реагируют по механизму SN2

Механизм:
Протонирование спирта: 
Протонированный спирт подвергается атаке нуклеофилом
|

Применение этой реакции ограничено получением симметричных эфиров, т.к. при использовании различных спиртов получается смесь трех эфиров.
Важным методом получения простых эфиров является реакция алкоксидов с алкилгалогенидами (синтез Вильямсона) или алкилсульфатами ROSO2OR.

Бόльшая нуклеофильность алкоксидиона RОy по сравнению со спиртом ROH означает бόльшую склонность к тому, чтобы выступать в качестве основания в реакции элиминирования. Поэтому при получении смешанных эфиров ROR1 следует учитывать возможность протекания конкурирующих реакций: нуклеофильного замещения и элиминирования. Например, для получения метилизопропилового эфира следует использовать йодистый метил и изопропилоксид натрия (пример 1), а не изопропилиодид и метоксид натрия (пример 2).
Пример 1:

Пример 2:

Вторичные и третичные спирты не подвергаются межмолекулярной дегидратации, а реагируют с образованием продуктов внутримолекулярной дегидратации - алкенов.
|

Образование алкенов – внутримолекулярная дегидратация. Под влиянием электроотрицательного кислорода на связанном с кислородом атоме углерода появляется положительный заряд, это вызывает поляризацию связи углерод-углерод и далее связи  .В определенных условиях водород при Сβ способен отщепляться в виде протона, происходит реакция элиминирования
.В определенных условиях водород при Сβ способен отщепляться в виде протона, происходит реакция элиминирования

Спирт превращается в алкен при температуре ~ 200 оС в присутствии серной или фосфорной кислоты, либо при пропускании паров спирта над окисью алюминия (Al2O3 - кислота Льюиса) при температуре 300-350 оС.
Механизм дегидратации Е1:
Первая стадия, медленная – диссоциация протонированного спирта с образованием карбониевого иона.

Вторая стадия, быстрая: карбокатион теряет протон и образует алкен.

|
Направление элиминирования. Элиминирование спиртов происходит с образованием более устойчивого, т.е. более алкилированного алкена (правило Зайцева).

Перегруппировка. Поскольку реакция Е1 протекает через стадию образования карбокатиона, она может сопровождаться перегруппировкой:

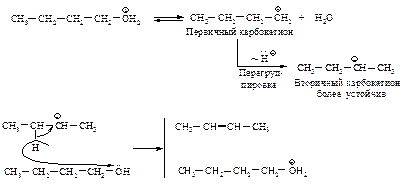
Дата добавления: 2014-12-30; просмотров: 506; Мы поможем в написании вашей работы!; Нарушение авторских прав |