
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические свойства. Карбоксил представляет собой сочетание карбонильной и гидроксильной групп
Карбоксил представляет собой сочетание карбонильной и гидроксильной групп. Свойства одной группы зависят от присутствия другой и не являются типичными свойствами альдегидов или спиртов, хотя существует значительное сходство в поведении гидроксильной группы в кислотах и спиртах, а карбонильной группы – в кислотах и альдегидах и кетонах.
6.2.1. Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
В водном растворе карбоновые кислоты диссоциируют с образованием карбоксилат-аниона и иона водорода.


Константы их кислотности Ка приблизительно равны 10-5. Даже будучи слабыми кислотами, они на много порядков более сильные кислоты, чем спирты. Это можно объяснить отсутствием в алкоксид-ионах стабилизации, которая имеет место в карбоксилат-ионах.
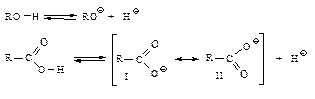
|
Соли. Поскольку карбоновые кислоты более сильные кислоты, чем вода, они легко переводятся в соли водными растворами щелочей. Под действием водных растворов минеральных кислот соли легко превращаются обратно в кислоты.
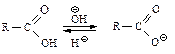
Соли натрия, калия, аммониевые соли карбоновых кислот растворимы в воде, но не растворяются в органических растворителях. Карбоновые кислоты и их соли щелочных металлов обладают противоположными характеристиками растворимости (за исключением С1–С4 – кислот, которые растворяются и в воде, и в органических растворителях). Это используют для очистки карбоновых кислот от органических примесей.
Влияние заместителей на кислотность. Электроноакцепторные заместители, способствующие распределению отрицательного заряда в анионе, делают его более устойчивым и тем самым увеличивают кислотность. Электронодонорные заместители увеличивают отрицательный заряд и дестабилизируют анион – кислотность уменьшается.
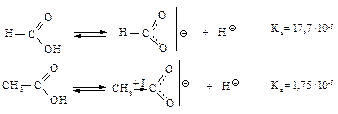
Электронодонорная группа -СН3 подает электроны, дестабилизирует анион, уменьшает кислотность.

Электроноакцепторная группа -ССl3 способствует распределению заряда, стабилизирует анион, увеличивает кислотность.
|


Почти все о-замещенные ароматические кислоты более сильные, чем бензойная кислота, независимо от характера о-заместителя.
Дата добавления: 2014-12-30; просмотров: 438; Мы поможем в написании вашей работы!; Нарушение авторских прав |