
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реакционная способность
Ацильные соединения, т.е. карбоновые кислоты и их функциональные производные, вступают в реакции нуклеофильного замещения групп Х: –ОН, –Сl, –OCOR, –OR, NH2.
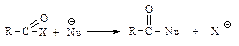
Первая стадия нуклеофильной атаки по карбонильному углероду одинакова для альдегидов, кетонов и ацильных соединений – образование продукта присоединения по двойной связи. Как и в случае альдегидов и кетонов, пространственные и электронные факторы делают карбонильную группу доступной для атаки нуклеофильным реагентом: а) атака нуклеофила по углероду плоской группы  не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (III); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении; дальнейшее превращение ионов (I) и (III) различно: промежуточный продукт, образующийся из альдегидов и кетонов (I), присоединяя протон, дает продукт присоединения (II), а промежуточный продукт, образующийся из ацильного производного (III), отщепляет группу Х, и в результате образуется продукт замещения (IV).
не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (III); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении; дальнейшее превращение ионов (I) и (III) различно: промежуточный продукт, образующийся из альдегидов и кетонов (I), присоединяя протон, дает продукт присоединения (II), а промежуточный продукт, образующийся из ацильного производного (III), отщепляет группу Х, и в результате образуется продукт замещения (IV).
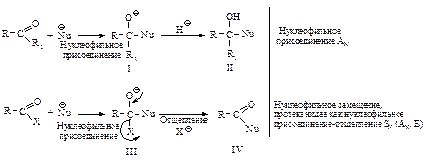
В случае ацильных соединений стабилизация промежуточного аниона происходит путем отщепления групп, которые являются слабыми основаниями Сly, RCOOy или сравнительно сильными основаниями R1Oy, NH2y. У альдегидов и кетонов во второй стадии реакции не происходит отщепления ионов Нy или Ry, так как они являются самыми сильными основаниями и, следовательно, очень “плохими” уходящими группами, поэтому вместо отщепления Нy или Ry происходит присоединение НÅ.
|
 с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Хy (уходящая группа). Способность быть “хорошей” уходящей группой соответственно уменьшается в ряду
с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Хy (уходящая группа). Способность быть “хорошей” уходящей группой соответственно уменьшается в ряду
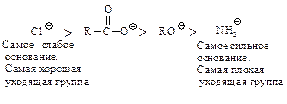
По легкости протекания второй стадии ацильные производные располагаются в следующий ряд:

Как и в реакциях альдегидов и кетонов, в случае слабого нуклеофила (Н2О, RОН) реакция катализируется кислотой: во-первых, протон НÅ делает карбонильную группу более доступной для нуклеофильной атаки (I), во-вторых, в этом случае образуется устойчивый незаряженный промежуточный продукт (II)

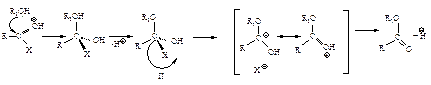
Хлорангидриды и ангидриды очень реакционноспособные соединения; даже со слабыми нуклеофилами они реагируют без катализатора. Например, хлористый ацетил бурно реагирует с водой, хлорангидриды ароматических кислот менее реакционноспособны.
|
Наиболее важными реакциями производных кислот являются следующие.
Гидролиз – превращение в кислоты. Наиболее реакционноспособными являются хлорангидриды 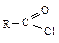 .Ацилхлориды алифатическогоряда гидролизуются в отсутствие катализатора, ароматические хлорангидриды
.Ацилхлориды алифатическогоряда гидролизуются в отсутствие катализатора, ароматические хлорангидриды 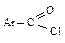 реагируют значительно медленнее.
реагируют значительно медленнее.
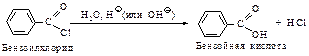
Алкоголиз – превращение в сложные эфиры

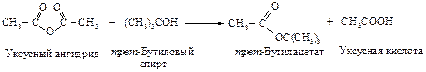
Реакция сложного эфира со спиртом с образованием нового эфира называется переэтерификацией.

Для того чтобы сместить равновесие вправо, используют большой избыток спирта R2OH или удаляют один из продуктов из реакционной смеси.
Примером использования реакции переэтерификации служит синтез поливинилового спирта. Его нельзя получить реакцией полимеризации винилового спирта. СН2=СН–ОН – неустойчивое соединение, но винилацетат – устойчив и может быть получен взаимодействием ацетилена с уксусной кислотой.
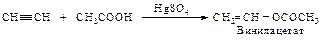
|

Поливинилацетат – сложный эфир, вступает во все реакции, характерные для сложных эфиров. Его можно ввести в реакцию переэтерификации с метиловым спиртом в присутствии серной кислоты.
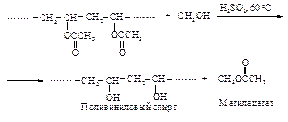
Низкокипящий метилацетат будет отгоняться, и реакция дойдет до завершения.
Аммонолиз – превращение в амиды
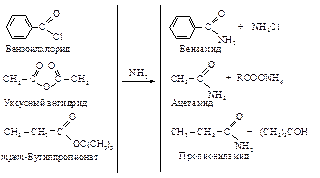
Взаимодействие сложных эфиров с реактивом Гриньяра. Реакция эфиров карбоновых кислот с реактивом Гриньяра – прекрасный метод получения кетонов и третичных спиртов.
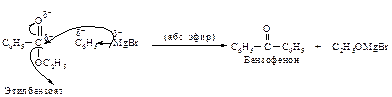
|
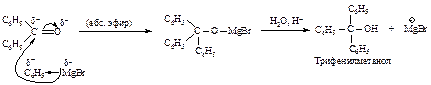
Для получения третичных спиртов предпочтительно использование в реакции сложного эфира, а не кетона, поскольку кетоны, как правило, менее доступны, чем сложные эфиры. Так, например, трифенилметанол можно получить по реакции фенилмагнийбромида, либо со сложным эфиром – этилбензоатом, либо с кетоном – бензофеноном. Проще – меньше стадий и лучше выходы – этерифицировать бензойную кислоту, чем превращать ее в хлорангидрид и проводить ацилирование бензола по Фриделю-Крафтсу с получением бензофенона.
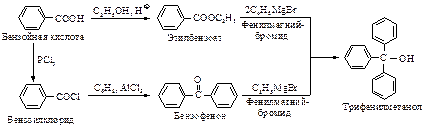
Реакция эфиров муравьиной кислоты НСООR, содержащих атом водорода при углероде карбонильной группы, с реактивом Гриньяра – отличный метод получения симметричных вторичных спиртов RCH(OH)R.
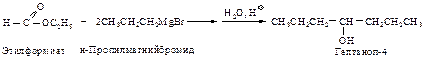
Дата добавления: 2014-12-30; просмотров: 305; Мы поможем в написании вашей работы!; Нарушение авторских прав |