
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Некоторые физические свойства нитрометана и ацетона
| Соединение | Молекулярная масса | Температура кипения, оС | Растворимость в 100 мл воды, г |
| Нитрометан СН3NO2 | 101,2 | 9-10 | |
| Ацетон CH3COCH3 | 56,2 | ∞ |
Нитроалканы представляют собой бесцветные жидкости с высокими для их молекулярных масс температурами кипения. Температура кипения нитрометана 101,2 оС; нитроэтана – 114 оС. Они обладают приятным запахом, перегоняются без разложения, мало растворимы в воде, ядовиты. Нитроалкены и нитроарены – жидкие или твердые вещества желтого цвета. Они тяжелее воды и не растворимы в ней. Эти нитросоединения имеют острый запах и высокотоксичны, особенно нитробензол.
|
Термодинамическая неустойчивость нитросоединений. Молярная теплота разложения нитрометана около 270 кДж/моль.
СН3NO2→ 1/2 N2 + CO2 + 3/2 H2
Значительная энергия и большая скорость такого процесса послужили основой для практического применения нитросоединений в качестве взрывчатых веществ.
Восстановление нитросоединений до аминов – наиболее важная реакция для синтеза азотсодержащих соединений.
Нитроалканы восстанавливают до алкиламинов оловом или железом в кислой среде, водородом в условиях гетерогенного катализа.
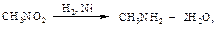 ∆Н= -356 кДж/моль
∆Н= -356 кДж/моль
Реакция восстановления нитроаренов протекает гладко при действии олова или железа в соляной кислоте, а также водорода Н2 (Ni), гидросульфидов металлов, цинка в щелочной среде.
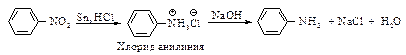
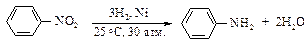
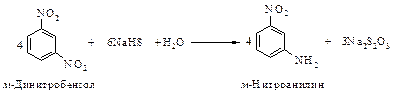
Реакция гидрирования очень экзотермична.
В нейтральном или щелочном растворе активность восстанавливающих агентов по отношению к нитробензолу меньше, чем в кислом растворе. Восстановление в присутствии щелочи идет через следующие стадии:
|

В зависимости от условий восстановление можно остановить на одной из стадий. Например, восстановление цинком в водном растворе хлористого аммония дает фенилгидроксиламин, а при действии цинка в водно-спиртовом растворе гидроксида натрия анилин превращается в гидразобензол.
Гидразобензол 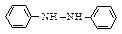 в сильнокислой среде претерпевает необычную перегруппировку, приводящую к образованию бензидина – очень важного промежуточного продукта в синтезе красителей. Скорость перегруппировки пропорциональна квадрату концентрации протона.
в сильнокислой среде претерпевает необычную перегруппировку, приводящую к образованию бензидина – очень важного промежуточного продукта в синтезе красителей. Скорость перегруппировки пропорциональна квадрату концентрации протона.

|
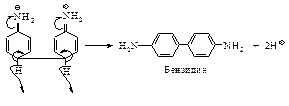
Реакции с участием a-водородных атомов - наиболее важные реакции нитроалканов.
Нитрометан обладает настолько сильными кислотными свойствами, что способен растворяться в едком натре.

Интересной особенностью этой соли является то, что при подкислении ее растворов образуется неустойчивый и обладающий очень сильными кислыми свойствами изомер нитрометана – ациформа, которая медленно превращается в нитрометан.
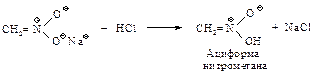
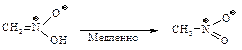
Первичные и вторичные нитросоединения вступают с карбонильными соединениями в реакции типа альдольной конденсации.
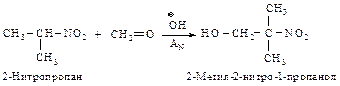
Механизм:
Образование под влиянием основания карбаниона (I) – устойчивого сопряженного основания.
|
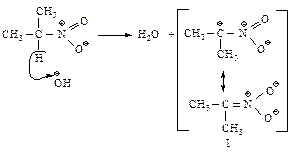
Далее происходит взаимодействие муравьиного альдегида с нуклеофилом (I) и образование промежуточного продукта (II).

Стабилизация промежуточного продукта (II) осуществляется за счет переноса протона от более слабого основания – гидроксид-иона к более сильному.
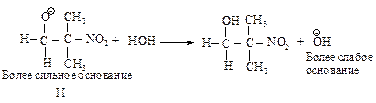
Дата добавления: 2014-12-30; просмотров: 452; Мы поможем в написании вашей работы!; Нарушение авторских прав |