
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Замещение в кольце ароматических аминов
При рассмотрении электрофильного замещения в ароматическом ядре амина, амида или аммонийной соли следует иметь в виду, что, хотя во всех случаях с углеродом ядра связан атом азота ориентанта, влияние его будет различно:
|
 –сильные активирующие о-, п-ориентанты;
–сильные активирующие о-, п-ориентанты;
 – менее сильный активирующий о-, п-ориентант;
– менее сильный активирующий о-, п-ориентант;
 – дезактивирующий м-ориентант.
– дезактивирующий м-ориентант.
Галогенирование. Реакция бромирования анилина протекает очень быстро, все свободные о-, п-атомы водорода замещаются галогеном.

Однако можно ввести один атом брома, предварительно проацилировав аминогруппу, понизить реакционную способность ароматического кольца, а после введения брома амидную группу гидролизовать. Бромирование ацетанилида в уксусной кислоте дает почти исключительно п-бромацетанилид.

Нитрование. Нитрование проводят с использованием ацетилированного, а не чистого амина. Во-первых, ацетилирование снижает реакционную способность кольца. Реакционноспособное кольцо ароматического амина крайне чувствительно к окислению. В обычных условиях нитрования значительное количество амина превращается в смолистые продукты окисления. Во-вторых, из свободного амина получается смесь, содержащая 1/3 пара- (ориентант – NH2) и 2/3 мета-продуктов замещения (ориентант –NH3Å). Ацетилированный амин гладко нитруется главным образом в п-положение.

|

Амиды сульфаниловой кислоты и некоторые родственные амиды представляют значительный интерес для медицины (сульфаниламидные препараты).
Сульфаниламиды получают взаимодействием сульфохлорида с аммиаком или с амином. Наличие в сульфаниловой кислоте аминогрупп создает специфическую проблему: если сульфаниловую кислоту превратить в хлорангидрид, то сульфогруппа одной молекулы будет атаковать аминогруппу другой молекулы.

Во избежание этого аминогруппу ацилируют до реакции получения сульфохлорида.
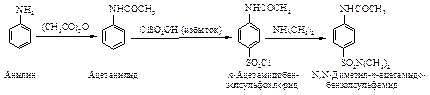
Амиды карбоновых кислот гидролизуются легче, чем амиды сульфоновых кислот.

|
Первичные амины ароматического ряда реагируют с азотистой кислотой с образованием солей диазония.

Первичные алифатические амины также дают соли диазония, но они очень неустойчивы и легко разлагаются.
Вторичные амины образуют нитрозоамины.


Третичные ароматические амины взаимодействуют с азотистой кислотой с образованием соединений, содержащих нитрозогруппу в ароматическом кольце.
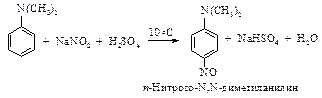
Поскольку  - слабый электрофильный реагент по сравнению сдругими электрофилами, нитрозирование происходит только в том случае, если в кольце имеется сильная электронодонорная группа. Реакция аминов с азотистой кислотой - это электрофильная атака
- слабый электрофильный реагент по сравнению сдругими электрофилами, нитрозирование происходит только в том случае, если в кольце имеется сильная электронодонорная группа. Реакция аминов с азотистой кислотой - это электрофильная атака  по атому, который имеетнаиболее высокую электронную плотность, т.е. по атому азота в первичных и вторичных аминах и по атому углерода в п-положении в третичных.
по атому, который имеетнаиболее высокую электронную плотность, т.е. по атому азота в первичных и вторичных аминах и по атому углерода в п-положении в третичных.
Дата добавления: 2014-12-30; просмотров: 645; Мы поможем в написании вашей работы!; Нарушение авторских прав |