
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
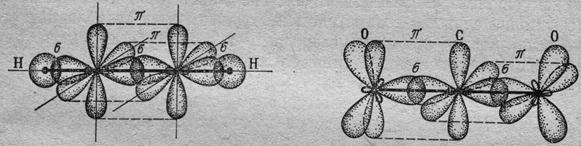
Б) молекула СО2.
Центральный атом углерода в этой молекуле имеет по кислороду к.ч.=2. С учётом рассуждений представленных в первом примере, можно предположить, что тип гибридизации орбиталей углерода в этой молекуле, так же как в молекуле С2Н2, sp. Т.е молекула имеет линейное строение. У атома углерода не принимали участия в гибридизации две одноэлектронные р-орбитали, направленные в пространстве перпендикулярно друг другу. У атомов кислорода после образования σ-связей осталось по одной одноэлектронной р-орбитали. При перекрывании р-орбиталей углерода с р-орбиталями кислорода (орбитали имеют одинаковые значения магнитных квантовых чисел) образуются две связи типа π, располагающиеся в двух взаимно перпендикулярных плоскостях справа и слева от атома углерода (рис. 26.3б).
(а) (б)
Рис.26.3. Строение молекул (а) С2Н2 и (б) СО2.
в) молекула С6Н6
По соотношению атомов, входящих в состав молекулы, С6Н6 аналогична С2Н2. Существует несколько возможных вариантов соединения атомов в данной молекуле (например, чередование одинарных и двойных связей между атомами углерода, образующих шестичленный цикл). Однако квантовомеханические расчёты показывают, что минимальную энергию система достигает в случае, когда все атомы углерода в молекулы равноценны как с точки зрения энергии, так и с точки зрения пространственного расположения.
При любом подходе к рассмотрению данной молекулы единственно возможный вариант существования системы, обеспечивающий участие всех валентных орбиталей углерода в образовании связи, а, следовательно, минимум энергии молекулы – образование замкнутого цикла из атомов углерода, т.е. к.ч.этих атомов в молекуле равно трём.
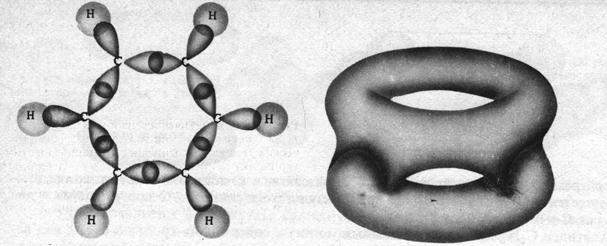
С учётом электронного строения атома углерода находим, что его орбитали находятся в состоянии sp2 гибридизации – молекула представляет собой правильный шестиугольник (угол между связями 120о). Каждый атом углерода после формирования системы σ-связей имеет по одной одноэлектронной орбитали типа р, ось которой располагается перпендикулярно плоскости молекулы. Выполнение условия равноценности всех химических связей в рассматриваемой молекуле может бать реализовано только в результате одновременного перекрывания всех указанных р орбиталей в двух областях молекулы: над и под плоскостью кольца (рис.27.3.). В результате указанного перекрывания образуется шестицентровая шестиэлектронная делокализованная химическая связь, одновременно принадлежащая всем атомам углерода данной молекулы.
а) б)
Рис.27.3. Система σ (а) и (б)π-связей в молекуле бензола.
г) Молекулы O3 и SO2
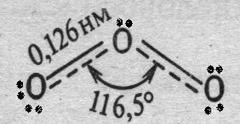
В данных молекулах центральные атомы имеют к.ч.= 2 и по две неподелённые электронные пары. С учётом строения атома в этом случае можно предположить, что тип гибридизации электронных орбиталей этих атомов sp3, однако данный вариант не оптимален с энергетической точки зрения в связи со значительной энергией отталкивания большого числа неподелённых пар валентного уровня. В то же время при sp2 гибридизации угол между связями может быть значительно увеличен, а одна из двухэлектронных р-орбиталей центрального атома получает возможность принять участие в образовании трёхцентровой четырёхэлектронной химической связи (рис.24.3 и 28.3). На первый взгляд может показаться, что имеющая меньшую длину связи молекула O3 термодинамически более стабильная система по сравнению с SO2, однако экспериментальные данные говорят об обратном: ∆G образования O3 при любых параметрах системы положительно, тогда как эта величина для SO2 в широком интервале параметров состояния системы отрицательна и велика по абсолютному значению.

а) б)
Рис.28.3. Строение молекул а) O3 и б) SO2
Данное противоречие легко разрешимо, если учесть, что атом кислорода не имеет свободных орбиталей валентного уровня и отталкивание неподелённых электронных пар в системе приводит к росту её внутренней энергии. У атома же серы имеются свободные d-орбитали валентного уровня, в связи с чем как минимум одна двухэлектронная орбиталь у каждого атома кислорода способна принимать участие в образовании связей по донорно-акцепторному механизму, что не только уменьшает энергию отталкивания в системе, но и снижает её суммарную энергию за счёт образования самих связей. Эксперимент и расчеты показывают, что связи в молекуле SO2 близки к тройным.
Дата добавления: 2014-11-13; просмотров: 725; Мы поможем в написании вашей работы!; Нарушение авторских прав |