
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Описание механизмов образования химических связей в рамках МВС
В настоящее время принято считать, что в основе одного из методов квантомеханического расчёта молекул лежат работы немецких учёных Гейтлера и Лондона, которые в 1927 году впервые применили его для расчёта энергии электронов в молекуле водорода. В дальнейшем указанный метод был развит в работах Слейтера, Ван Флека, Полинга и получил название метода валентных связей (МВС) или локализованных электронных пар.
Рассмотрим принципы данного метода на примере описания молекулы Н2. Данная молекула представляет собой совокупность двух ядер Нa и Hb и двух электронов, пространственные координаты которых обозначим 1 и 2 (рис.9.3). Тогда потенциальная энергия для молекулы Н2 будет определятся соотношением:
V = e2/Rab + e2/r12 - e2/ra1 - e2/ra2 - e2/rb2 - e2/rb1 (6.3)
В качестве волновой функции электронов молекулы водорода Гейтлер и Лондон использовали волновую функцию электрона в атоме водорода в 1s –
состоянии, т.е. функцию вида : ψ1s = e-r/a/√πa3 (7.3)
где r – расстояние электрона от ядра; а – радиус первой боровской орбиты.

Рис.9.3. Условная схема распределения частиц в молекуле водорода по Гейтлеру и Лондону.
Обозначим волновую функцию электрона в первом изолированном атоме ψa(1), а во втором - ψb(2). Если атомы находятся на значительном расстоянии друг от друга, то состояние их электронов остаётся неизменным и волновая функция такой системы, состоящей из двух изолированных атомов, может быть записана в виде: ψ = ψa(1) ψb(2). Поскольку электроны неразличимы, то можно считать, что с равной вероятностью электрон (1) движется в поле ядра (b) , а электрон (2) в поле ядра (a), тогда волновая функция системы: ψ = ψa(2) ψb(1), т.е. получаем состояние системы с той же энергией. Обе из приведённых функций предусматривают движение каждого из электронов в поле конкретного ядра, что не отвечает концепции общей электронной пары. Так как в молекуле оба электрона должны одновременно находиться как в поле ядра (a), так и в поле ядра (b) волновая функция для молекулы, учитывающая указанное выше состояние электронов, должна быть линейной комбинацией двух ранее рассмотренных функций:
Ψм = с1 ψa(1) ψb(2) + с2ψa(2) ψb(1) (8.3)
Тогда вероятность нахождения электронов в пространстве между ядрами:
Ψ2м = (с1 ψa(1) ψb(2))2 + (с2ψa(2) ψb(1))2 + 2с1с2ψa(1) ψb(2) ψa(2) ψb(1) (9.3)
Т.е. в данном случае происходит не простое сложение вероятностей, а их интерференция (усиление), в результате чего электронная плотность между ядрами оказывается более высокой, чем простая сумма этих плотностей. Вариационный метод даёт два решения системы уравнений (5.3) : с1 = с2 и с1 = - с2, т.е. возможны два варианта волновой функции – симметричная ( S) и антисимметричная (А) – ΨS и ΨA:
ΨS = сS[ ψa(1) ψb(2) + ψa(2) ψb(1) ] (10.3)
ΨA = сA[ ψa(1) ψb(2) - ψa(2) ψb(1)] (11.3)
Для первой из функций электроны и ядра системы неразличимы (если их поменять местами, т.е. переставить индексы (1) и (2) или (a) и (b), то функция ΨS останется неизменной), поэтому её называют симметричной относительно координат, как ядер, так и электронов. В то же время, если провести указанную перестановку для функции ΨA произойдёт изменение её знака, т.е. функция ассиметрична по отношению координат частиц, образующих молекулу водорода.
Физический смысл симметричной и антисимметричной волновых функций становится понятным, если принять во внимание, что состояние электрона в любой системе предопределяется не только характеристиками орбитали, но и значением спинового квантового числа. В то же время при выводе функции (8.8) значение спинового квантового числа электронов не учитывалось (так же как в любых квантовомеханических расчётах по методу Шрёдингера). Тогда, учитывая принцип Паули, согласно которому в стабильной системе не могут сосуществовать два электрона с одинаковыми значениями всех четырёх квантовых чисел, можно сделать вывод о том, что электроны, образующие общую электронную пару для достижения системой минимума энергии должны иметь противоположные значениями своих спиновых квантовых чисел. Это связано с тем, что электроны этой пары располагаются в молекуле на одной орбитале (в одной и той же области пространства) и, следовательно, значения остальных квантовых чисел для них совпадают. Если же принцип Паули не выполняется, энергия системы при образовании общей электронной пары из электронов с одинаковыми значениями должна повышаться по сравнению с исходным состоянием, т.е. в этом случае самопроизвольное образование химической связи невозможно. Последний вывод можно доказать математически, используя уравнение (9.3):
Ψ2S = (с1 ψa(1) ψb(2))2 + (с2ψa(2) ψb(1))2 + 2с1с2ψa(1) ψb(2) ψa(2) ψb(1)
Ψ2A = (с1 ψa(1) ψb(2))2 + (с2ψa(2) ψb(1))2 - 2с1с2ψa(1) ψb(2) ψa(2) ψb(1)
Из уравнений, что симметричная волновая функция описывает состояние системы, характеризующееся увеличением электронной плотности в межядерном пространстве ( атомные волновые функции складываются) и, следовательно, электроны в общей паре имеют различные значения спиновых квантовых чисел. Как отмечалось выше электронная плотность в межядерном пространстве в этом случае больше, чем сумма электронных плотностей изолированных атомов – этот вывод описывается в виде терминов «перекрывание атомных электронных орбиталей» или «перекрывание волновых функций электронов», что указывает на изменение состояния электронов в процессе образования общей электронной пары.
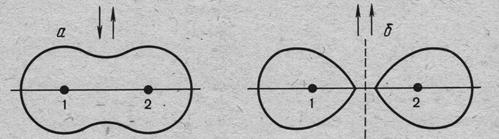
Рис.10.3. Изменение электронной плотности в системе, состоящей из двух атомов водорода в процессе формирования общей электронной пары из электронов (а) – с антипараллельными и (б) – с параллельными спинами.
В то же время антисимметричная волновая функция описывает состояние системы, при котором сближение ядер атомов приводит к росту энергии системы ( отрицательный знак перед последним слагаемым ряда), т.е. между электронами, формально способными образовать химическую связь, при сближении атомных ядер возрастают силы отталкивания. Такое изменение энергии в рассматриваемой системе возможно только при одинаковых значениях спиновых квантовых чисел этих электронов.
Результаты расчёта энергии в молекуле водорода с использованием ΨS и ΨA представлены на рис. 2.3, а изменение электронной плотности в системе при формировании общей электронной пары с использованием электронов с антипаралельными и параллельными спинами – на рис.4.3. Энергия химической связи, вычисленная Гейтлером и Лондоном, составила 414,5 кДж/моль при значении длины связи (re) равным 0,86 Ǻ и складывается из энергии следующих взаимодействий:
Притяжение электронов и ядер …………………… - 4262,2 кДж/моль
Отталкивания электронов …………………………. 1540,7 кДж/моль
Отталкивание атомных ядер ………………………. 1905,1 кДж/моль
Кинетическая энергия электронов ………………… 401,9 кДж/моль
∑- 414,5 кДж/моль
Рассчитанные характеристики связи в молекуле Н2 отличаются от экспериментально найденных менее чем на 10%, что свидетельствует о принципиальной применимости квантовой механики для количественной интерпретации химической связи. При этом необходимо отметить, что при уточнении вида используемых волновых функций (за счёт учета деформации исходных электронных орбиталей, минимизации энергии отталкивания электронов в паре и т.д.), расхождение между рассчитанными и экспериментальными данными можно снизить до 0,01%. Таким образом, можно считать доказанным, что ковалентная связь представляет собой взаимодействие электрически заряженных частиц, осуществляемое в условиях квантомеханической микросистемы и обеспечивающее достижение системой минимума энергии при её заданном качественном и количественном составе.
Известно несколько способов перекрывания орбиталей, приводящих к образованию химической связи. Связь типа σ образуется в результате перекрывания атомных орбиталей вдоль линии, соединяющей ядра атомов (рис.11.3).

Рис.11.3. Образование σ-связей: (а) - типа s-s, (б) - типа s-p, (в) - типа p-p.
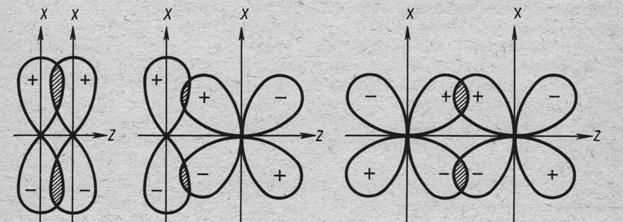
Если в процессе образования химической связи орбитали типа p, d или f перекрываются в плоскости параллельной оси σ-связи своими боковыми частями, то образуется π-связь (рис.12.3 и 13.3).
а б в
Рис.12.3 Образование π-связей: (а) - типа p-p, (б) - типа p-d, (в) - типа d-d. (z – ось σ-связи).

Рис. 13.3 Электронное облако π-связи типа p-p (А – В – ось σ-связи).
При боковом перекрывании d или f орбиталей в плоскости перпендикулярной σ-связи образуются δ-связи (рис.14.3).
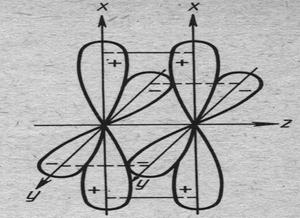 Рис. 14.3. Схема перекрывания d орбиталей при образовании δ-связи. (z – ось σ-связи).
Рис. 14.3. Схема перекрывания d орбиталей при образовании δ-связи. (z – ось σ-связи).
Одним из возможных способов образования связей согласно МВС является перекрывание одноэлектронных орбиталей валентного уровня атомов в процессе их взаимодействия. Данный вариант формирования общей электронной пары исторически принято называть «обменным» («обмен» в данном случае характеризует не природу связи, а является методом расчёта принятом в МВС). Оставаясь в рамках общепринятого термина, «обменным» будем называть способ образования ковалентной связи, при котором происходит перекрывание двух валентных орбиталей различных атомов, имеющих по одному электрону. Например, атомы водорода имеют в своём составе по одному электрону в 1s состоянии. При перекрывании этих орбиталей (рис.11.3.а) образуется σ-связь, характеристики которой описаны выше. Так как электроотрицательность атомов, принимающих участие в образовании данной связи одинакова, общая электронная пара имеет наименьшую энергию в области, находящейся на равном расстоянии от центров ядер атомов, т.е. σ-связь в молекуле Н2 неполярна. Образование молекул типа Нn где n > 1 невозможно в связи с тем, что, например, при присоединении атома Н к молекуле Н2 электрон третьего атома будет совпадать по значению спина с одним из электронов, входящих в состав общей электронной пары (рис. 11.3.б). Как было показано ранее это приведёт к росту энергии системы, т.е. с энергетической точки зрения более устойчивым её состоянием будет совокупность частиц (Н2 + Н), а не молекула Н3. Способ описания молекул простых веществ других элементов представлен на рис.15.3.

Рис.15.3. Образование связей в молекулах N2, O2 и F2
Атом фтора имеет одну 2р орбиталь с неспаренным электроном. При образовании молекулы F2 происходит перекрывание этих орбиталей с образованием σ-связи типа р-р (рис. 11.3.в). Отсутствие свободных орбиталей валентного уровня у взаимодействующих атомов предопределяет невозможность образования связей по второму возможному механизму, который будет рассмотрен ниже.
Атомы кислорода имеют две одноэлектронные орбитали 2р подуровня, что делает возможным образования двух типов связей между атомами в молекуле O2: σ-связи типа р-р и π-связь, также типа р-p.
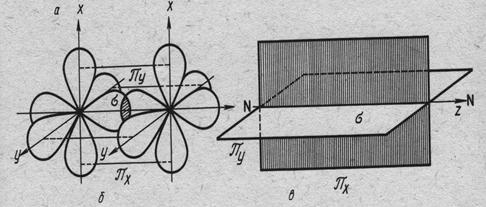
Рис.16.3. Схема химической связи в молекуле N2. σ-связь образована за счёт перекрывания рz орбиталей, π-связи – перекрыванием рx и py орбиталей в плоскостях ху и уz, соответственно.
У атомов азота на 2р подуровне три одноэлектронные орбитали и, следовательно, эти атомы связаны в молекуле N2 тройной связью: σ-связь типа р-р и две π-связи типа р-p, расположенные в двух взаимно перпендикулярных плоскостях (рис.16.3.).
Наличие в молекулах связей, образованных только по «обменному» механизму, характерно для водородных соединений элементов главных подгрупп IV – VII групп, большинства органических соединений, неорганических соединений углерода, фторида азота, его оксидов и ряда других веществ. Это позволяет прогнозировать количественный состав указанных молекул, основываясь на строении атомов, из которых формируется частица. Например, исходя из строения атомов азота и фтора (рис.15.3) можно сделать вывод, что наличие у атома азота трёх одноэлектронных орбиталей предопределит возможность присоединение к этому атому трёх атомов фтора, каждый из которых имеет только по одной такой орбитали, т.е состав фторида азота – NF3. Рассуждая аналогично можно показать, что азот может теоретически иметь три водородных соединения различного состава, кислород – два, а фтор – одно:
NH3, H2N – NH2 и HN = NH; H2O и HO – OH; H – F
В отличии от простых веществ, рассмотренных ранее, в молекулах сложных веществ общая электронная плотность возникшая в результате перекрывания орбиталей атомов различных элементов смещена в сторону более электроотрицательного атома, т.е. является полярной. Необходимо отметить, что в молекулах сложных веществ могут одновременно сосуществовать как полярные, так и неполярные связи. Например, в молекулах NH3, H2O, HF, H2N – NH2 и HO – OH связи водорода с азотом, кислородом и фтором полярны, тогда как связи между атомами азота в гидразине и связи между атомами кислорода в пероксиде водорода - неполярны.
Однако энергетические характеристики молекул, в состав которых входят атомы элементов третьего и последующих периодов, а также атомы бора, бериллия и лития невозможно интерпретировать в рамках только «обменной» концепции образования ковалентной связи. Кроме этого, в ряде случаев, используя только данный механизм, невозможно понять причину существования целого ряда термодинамически стабильных молекул и ионов, таких как BNF6, NH4+, AI2I6, B3N3H6 и т.д., не говоря уже о возможности предсказания существования подобных частиц.
Как было показано на примере квантовомеханической интерпретации образования связи в молекуле водорода, результирующая волновая функция, описывающая состояние общей электронной пары в молекуле, является линейной комбинацией атомных орбиталей. При этом к электронам общей пары предъявляется только два требования – они должны иметь противоположные значения спиновых квантовых чисел и их исходная энергия, как максимум, должна соответствовать энергии одной из перекрывающихся орбиталей, с наибольшим значением главного квантового числа. Отсюда можно сделать вывод, что энергетически обоснованным является механизм образования ковалентной связи, заключающийся в перекрывании свободной валентной орбитали одного атома с валентной орбиталью другого атома, имеющего неподелённую электронную пару:
А: + □В = А – В
Такой механизм получил название донорно - акцептороного. Атом, предоставляющий для образования связи двухэлектронную орбиталь называется донором ( атом А), а его партнёр – акцептором (атом В). Очевидно, что механизм образования связи не влияет на её энергию, т.к. последняя предопределяется только энергетическими характеристиками перекрывающихся орбиталей. Например, как было показано выше (рис.10.8) в молекуле F2 между атомами фтора образуется только одна σ- связь. Взаимодействие же между атомами хлора, строение валентного уровня которого представлено на рис. 17.3б., может быть более многообразным: помимо образования σ- связи за счёт перекрывания одноэлектронных 3р атомов, возможно образование дополнительных π-связей за счёт перекрывания свободных 3d орбиталей одного атома с духэлектронными 3р орбиталями атома – партнёра. Такой вывод подтверждается, в частности, ростом суммарной энергией связи в молекуле при переходе от F2 к CI2. Также образованием дополнительных связей по донорно-акцепторному механизму между атомами серы (строение валентного уровня этого атома представлено на рис.17.3а.) объясняется стабильность цепочек - S – S – S - , характерных для простых веществ данного элемента и его соединений.

Рис.17.3 Распределение электронов по валентным орбиталям у атомов серы и хлора.
Также без учёта второго механизма образования ковалентной связи невозможно оценить суммарную энергию и полярность связи в молекуле СО, изоэлектронной молекуле N2 (рис.16.3 и 18.3). Как видно из представленной схемы связь в этой молекуле тройная: σ и одна из π-связей образованы по «обменному», а ещё одна π-связь – по донорно-акцепторному механизму. В связи с этим, формально, электронная плотность первых двух связей смещена к более электроотрицательному атому О. Одновременно этот атом выступает в роли донора при образовании третьей связи, т.е. её электронная плотность смещается от атома О к атому С, что компенсирует избыточный отрицательный заряд на атоме кислорода. В результате суммарное смещение электронной плотности относительно центра σ-связи оказывается равным нулю и, следовательно, молекула СО неполярна (так же как молекула N2).
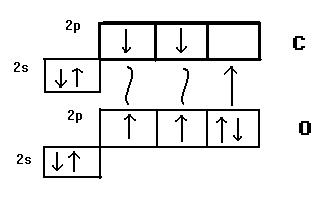
Рис.18.3. Перекрывание орбиталей в молекуле СО
Очевидно, что и значения суммарной энергии связи в молекулах N2 и СО будут близки.
Подводя предварительный итог рассмотрения молекул в рамках МВС можно сделать вывод, что валентность атомаэто число химических связей, которые образует данный атом со всеми партнёрами в рассматриваемой молекуле по «обменному» и донорно-акцепторному механизмам. Следовательно, максимальная, теоретически возможная валентность атомов равна числу их валентных орбиталей. Предлагаем читателям определить валентность атомов во всех молекулах, рассмотренных в данном модуле.
Дата добавления: 2014-11-13; просмотров: 500; Мы поможем в написании вашей работы!; Нарушение авторских прав |