
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Индукционный эффект.
Этот эффект возникает также только в том случае полярных молекул (для индивидуальных веществ), когда диполь-дипольное взаимодействие приводит к увеличению μ взаимодействующих молекул. За счет взаимной деформации происходит смещение центров положительного и отрицательного заряда диполей. Как показал Дебай (1920) Еинд может быть рассчитана по формуле:
Еинд = – (  ) = –
) = – 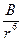

Где α – поляризуемость (деформируемость) молекулы.
Еинд возрастает с ростом μ и деформируемости молекул и быстро падает при увеличении расстояния между ними. В то же время Еинд от Т не зависит, так как наведение липолей происходит при любом пространственном расположении молекул. Еинд в 10-20 раз меньше Еор. Более или менее ощутимое влияние индукционного взаимодействия наблюдается только для частиц, обладающих большой поляризуемостью. Например, вклад Еинд в суммарную энергию межмолекулярного взаимодействия для NH3 выше, чем для H2O . Это объясняется тем, что поляризуемость молекул NH3 ше, чем молекул Н2О, хотя μ(NH3)<μ(H2O).
2.5.3. Дисперсионный эффект.
Этот эффект реализуется при взаимодействии любых атомов и молекул, независимо от строения и полярности, т.е. он является универсальным. В рамках квантовомеханических представлений дисперсионный эффект объясняется синхронизацией мгновенных диполей взаимодействующих частиц (Дебай 1920). Рассмотрим систему, состоящую из ядра и движущихся электронов. В любой момент времени вследствие несовпадения центров электронных облаков и ядра такая система представляет собой мгновенный диполь. Число таких диполей равно числу электронов системы. Электрическое поле мгновенных диполей атомов и молекул индуцирует мгновенные диполи в соседних частицах. Каждый из диполей будет влиять на ориентацию подобных мгновенных диполей, возникающих в близлежащих молекулах. В результате этого движение многих мгновенных диполей перестает быть независимым и становится синхронным. Их появление и исчезновение в разных молекулах происходит в такт друг другу. В результате частицы испытывают притяжение друг к другу и энергия системы снижается.
Едис = – 
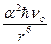 = –
= – 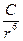
Где h – постоянная Планка, √о – частота колебаний, отвечающих
нулевой энергии, присущая каждому атому или молекуле при ОоК.
Приближенно һ√ о= I1, тогда
Едис = – 
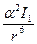 = –
= – 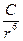
Складывая все три составляющие Ван-дер-Ваальсовых сил получим:
Е = - 
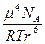 –
–  –
– 
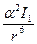 = –
= – 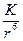
Где К = А+В+С.
Величина вклада отдельных составляющих в суммарном эффекте зависит от состава и структуры молекул. Причем, наиболее существенными для межмолекулярного взаимодействия являются такие их свойства как полярность и поляризуемость. Чем выше полярность молекул, тем значительнее роль ориентационных сил. В то же время с ростом поляризуемости возрастает дисперсионный эффект. Индукционный эффект зависит от обоих факторов, но сам по себе имеет лишь второстепенное значение.
Таблица 14.2. Энергия межмолекулярного взаимодействия для
молекулярных веществ и температуры их кипения (ТкипоС )
| вещество | μ (D) | Поляризу-емость | Эффект в ккал ⁄ моль | Е∑ | ТкипоС | ||
| Eop | Еинд | Едис | |||||
| H2 | 0,20 | 0,04 | 0,04 | 20,21 | |||
| Ar | 1,63 | 2,03 | 2,03 | ||||
| Xe | 4,00 | 4,40 | 4,40 | ||||
| HCl | 1,03 | 2,63 | 0,79 | 0,24 | 4,02 | 5,05 | |
| HBr | 0,78 | 3,58 | 0,26 | 0,17 | 6,80 | 7,23 | |
| HI | 0,38 | 5,40 | 0,14 | 0,075 | 14,47 | 14,56 | |
| NH3 | 1,5 | 2,21 | 3,18 | 0,37 | 7,07 | 7,07 | 239,6 |
| H2O | 1,84 | 1,48 | 8,69 | 0,46 | 11,30 | 11,30 |
Cуммарная энергия межмолекулярного взаимодействия очень мала по сравнению с энергией ковалентной связи – она, зачастую, меньше энергии ковалентной связи в 10–100 раз. Температуры плавления веществ, образованных неполярными молекулами возрастают по мере увеличения деформируемости образующих систему частиц. Например, при нормальных условиях F2, Cl2 – газы, Br2 – жидкость, J2 – твердое вещество. Учет межмолекулярных Ван-дер-Ваальсовых сил необходим и в других случаях, например, при расчете теплоты плавления, сублимации и т.д.
В рамках самоподготовки по модулю 2 предлагается обсудить следующие вопросы:
1. Опишите изменения происходящие с электронными оболочками ионов при сближении двух противоположно заряженных частиц.
2. Каков порядок напряжённости электрического поля вблизи однозарядного иона?
3. Дайте определение понятию «деформируемость», сформулируйте условия определения её относительного значения.
4. Как изменяется деформируемость атомов от гелия до радона? Почему?
5. Какая величина называется «поляризующим действием» (ПД) иона, от каких факторов она зависит?
6. Как и почему изменяется (ПД) катионов элементов главной подгруппы второй группы?
7. Расположите анионы типа ЭО32- (Э= C, N, S) по мере роста их ПД и дайте объяснение предложенному варианту.
8. Объясните явление, которое называется контрполяризующим действием.
9. Когда и почему происходит аномально высокая деформация электронных оболочек взаимодействующих ионов?
10.Как рост ПД катиона сказывается на его КЧ в кристаллической решётке?
11.Ионы Ме2+ у железа и цинка имеют близкие значения ионных радиусов. Почему их оксиды типа МеО имеют различное строение (для каждого из оксидов укажите тип кристаллической решётки)?
12.Как и почему изменяются температуры плавления галогенидов элементов главных подгрупп I и II групп?
13.Как изменение ПД влияет на энергию кристаллической решётки?
14.Как по значению ПД катиона определить тип и степень диссоциации соединений типа R-O-H?
15.Как используя представления о значении ПД катиона и аниона предсказать возможность гидролиза данной частицы и оценить степень её гидролиза?
16.Почему с ростом основности кислоты степень её диссоциации снижается?
17.Почему литий возглавляет ряд напряжений?
18.Как и почему изменяется стабильность форм при переходе от кислоты к её соли?
19.Как и почему изменяются окислительные свойства перманганат- ионов при уменьшении рН раствора?
20.Укажите на какие вопросы способна ответить теория поляризации и каковы её недостатки.
21.Укажите знаки изменения энтропии и энтальпии при ассоциации молекул.
22.Почему реальные газовые системы не могут быть описаны в рамках уравнения идеального газа?
23.Между молекулами с каким типом химической связи возможен ориентационный тип взаимодействия, от каких величин и параметров состояния системы он зависит?
24.Опишите механизм индукционного взаимодействия. Между молекулами каких типов он возможен, какие факторы предопределяют его значения?
25.Какое взаимодействие называется дисперсионным? От каких факторов зависит его вклад в общую энергию межмолекулярного взаимодействия?
26.Какие свойства молекулярных веществ можно предсказывать на основе представлений о межмолекулярном взаимодействии?
27.Сравните суммарную энергию трёх типов межмолекулярного взаимодействия для HI и H2O (табл.1.6). Почему температура кипения воды выше, чем у HI?
28.Почему СО имеет температуру кипения практически такую же как азот?
29.Почему изменение температур кипения и плавления в ряду галогенводородов носит экстремальный характер?
30.Расположите оксиды азота в ряд по мере увеличения их температур плавления и дайте объяснение предлагаемому варианту.
Проектное задание
Выявите основные принципы построения энергетических диаграмм образования ионной связи, установите корреляцию между составом, строением и свойствами веществ с преимущественно ионным характером связи, укажите фазы, которые успешно могут быть описаны в рамках изученной теории, отметьте её недостатки. Рассмотрите свойства галогенидов, оксидов и солей кислородных кислот с точки зрения теории поляризации, установите зависимости между свойствами газообразных веществ и энергией межмолекулярного взаимодействия.
Дата добавления: 2014-11-13; просмотров: 554; Мы поможем в написании вашей работы!; Нарушение авторских прав |