
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные принципы модели жесткой сферы
Ионы, имеющие электронную структуру атомов инертных газов, можно считать сферически симметричными. В связи с этим силы их притяжения к ионам противоположного знака одинаковы в любом направлении. Поэтому структура ионных кристаллов определяется только геометрическими факторами: соотношением числа ионов различного сорта в кристаллической решетке (определяемого по формуле соединения) и их размерами. Последний фактор предопределяется отношением радиусов ионов, например г+/г–.
В основе прогноза строения кристалла также лежит принцип его электронейтральности как макрообъекта и принцип минимума энергии.
Составляющими, вносящими вклад в энергию кристаллической решетки вещества, являются:
- силы притяжения между противоположно заряженными ионами, которые возрастают с увеличением КЧ и уменьшением межядерного расстояния между противоположно заряженными ионами;
- силы отталкивания, возрастающие при сближении одинаково заряженных ионов.
В рамках концепции жёстких сфер минимальные расстояния между одинаковыми ионами равны сумме их ионных радиусов, когда они «касаются» друг друга в кристаллической решетке.
Рассмотрим с учетом вышеизложенного соединение типа МХ (т.е. с равным числом катионов и анионов), в котором КЧ = 6 (октаэдрическое расположение ионов Х– вокруг иона М+ и ионов М+ вокруг ионов Х– (рис. 4.2).

|

|
| Рис. 4.2 – Структура NaCl (элементарная ячейка хлорида натрия изображена сплошными линиями). | Рис. 5.2 – расположение ионов М+ и Х–, находящихся в плоскости основания. |
Тогда cb = ab · cos450 где ab = r0 M–X cb=rx-
rX- = (rM+ + rX-) / √2
 = √2 – 1 = 0,414
= √2 – 1 = 0,414
т.е. это величина отношения радиусов катиона и аниона предельно возможная для данной структуры. При дальнейшем росте радиуса аниона (или уменьшении гм+), должно произойти уменьшение КЧ, в частности, может формироваться структура типа ZnS с КЧ=4, для которой критическое соотношение радиусов ионов равно 0,22. Если же значения rм+ и rх- будут сближаться, то при соотношении rм+/rх- >0,732 будет наблюдаться рост КЧ до 8 и образуется структура типа CsCl (рис. 6.2).
Рис. 6.2. Структура CsCl (справа – элементарная ячейка).

| |
Если ионов одного вида вдвое больше, чем другого (т.е. состав соединения M2X или МX2), то в структурах с учетом указанного состава координационные числа этих двух видов ионов должны быть в отношении 1:2 или 2:1, соответственно. При соотношениях ионных радиусов >0,732 образуется структура типа флюорита (СаF2), в которой каждый ион Са2+ окружен восьмью ионами F–, расположенных по углам куба, а каждый ион F– – четырьмя ионами Са2+.
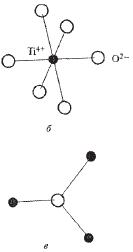
При соотношении rм+/rх- от 0,414 до 0,732 образуется структура типа рутила (TiО2) (рис. 7.2 и 8.2).


Рис. 7.2 – Структура флюорита Рис.8.2 – Структура рутила.

|  
|
| Рис. 7.2а– структура CaF2 | Рис. 8.2а –структура TiO2 |
В рутиле каждый ион титана октаэдрически окружен шестью ионами кислорода, а вокруг каждого иона кислорода расположены по вершинам равнобедренного треугольника три иона титана. Так образом КЧ ионов титана равно 6, а КЧ ионов кислорода - 3.
Дата добавления: 2014-11-13; просмотров: 466; Мы поможем в написании вашей работы!; Нарушение авторских прав |